(14分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
请回答下列问题:
(1)操作I、II的名称分别是________、_________。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。

(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g) H =+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式: 。
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为_____________。
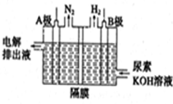
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极。请写出阳极的电极反应方程为_____________。
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。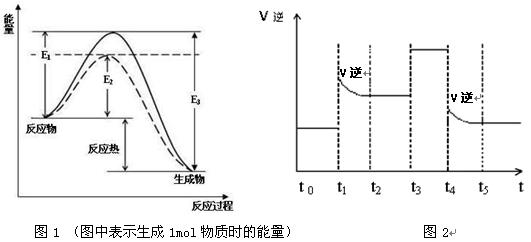
(1)根据图1请写出合成氨的热化学方程式(热量用E1、E2或E3表示)
(2)图1中虚线部分是通过改变化学反应中的条件,请解释原因
。
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是(“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为(已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题: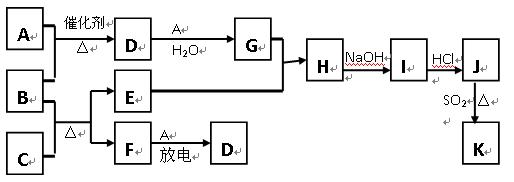
(1)B的电子式为;
(2)写出B和C反应的化学方程式;
(3)写出E与G的稀溶液的离子方程式,并标出电子转移数目:
;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:F(g) + A(g) =" 2D" (g) △H = +180.5KJ/mol
2C (s)+ O2 (g)=" 2CO(g)" △H = -221.0 KJ/mol
-221.0 KJ/mol
C (s)+ O2(g) = CO2(g) △H =" -393.5" KJ/mol
则上述尾气转化的热化学方程式为:。
高铁酸钾是一种重要的水的处理剂,实验可用下列流程制取高铁酸钾,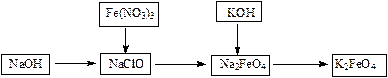
⑴NaClO溶液中加入NaOH固体形成碱性环境。
⑵将研磨的Fe(NO3)3少量多次的加入到上述溶液中,冰浴中反应1h。
采用少量多次加入,其目的是___________________________;该反应的离子方程为:
_____________________________________。
⑶将KOH加入到反应后的溶液搅拌半小时。静置,抽滤的粗产品。该反应的化学方程式为:_____________________________。
⑷依次用甲苯、乙醇、乙醚洗涤以除去水份和KNO3、KCl、KOH等杂质。
⑸在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色。现称取5.000 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00mL,再用稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。
①滴定时适宜选用的滴定管是:(a、酸式,b、碱式)。
②计算上述实验制得的样品中,高铁酸钾的质量分数为_________________。
③若上述过程中,测得的样品中高铁酸盐的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________。
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质且利用率较高。合成路线如下: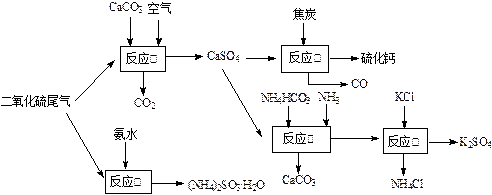
⑴生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
⑵下列有关说法正确的是_______________。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
⑶反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是_________________________。
⑷(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,若某尾气含标准状况试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________。
已知X、Y、Z、W四种短周期主族元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,最外层电子数之和为10。据此回答下列有关问题:
⑴X、Y、Z处于____________周期。
⑵若Z原子最外电子数是Y原子最外层电子数的2倍。则元素Y的最高价氧化物对应水化物在水中的电离方程式为_______________;X和W形成的化合物XW2的电子式为________。
⑶若X、W能形成1:1型离子化合物,则其水溶液呈_______性(填“中”、“酸”、“碱”),
并写出电解YZ2溶液的化学方程式___________________________。