请回答下列问题:
(1)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有 ,用离子方程式表示X溶液呈酸性的原因是 。
(2)E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体已知[n(A):n(B)=3:1],可放出l8.44 kJ热量,则该反应的热化学方程式为 。
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极反应式为 。
(5)在10L的密闭容器中,通人2molFC2气体和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为 。
某无色透明浓溶液,跟金属铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、OH-、NO3-何者能存在于此溶液中,当生成Al3+时可存在________;当生成AlO2-时可存在________。
下表是某种常见金属的部分性质:
| 颜色 状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
| 银白色 固体 |
较软 |
2.70 g·cm-3 |
660.4℃ |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投入稀盐酸中可产生大量的无色气体。试回答:
(1)推断该金属可能的一种用途:________,该金属的活泼性比铜________(填“强”或“弱”)。
(2)请自选试剂,设计不同的实验方案探究该金属与铁的活泼性强弱,并完成下表:
| 猜想 |
验证方法 |
预测实验现象 |
| 该金属比铁活泼 |
||
| 该金属活泼性比铁弱 |
写出下列反应的离子方程式:
(1)在氯化锌溶液中加入过量的氨水____________________________________;
(2)在硫酸铜溶液中加入过量的浓氨水____________________________;
(3)氯化银溶于浓氨水_____________________________________________________;
(4)在FeCl3溶液中加入过量的氨水
________________________________________________________________________。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化: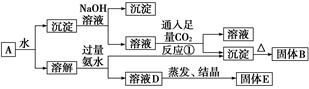
据此判断:
(1)固体B所含物质的化学式为____________________________________________。
(2)固体E所含物质的化学式为______________________________________。
(3)反应①的离子方程式为________________________________________________。
下表是元素周期表的一部分,列出了十个元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
VIA |
VA |
VIA |
VIIA |
0 |
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是(填物质化学式),
呈两性的氢氧化物是(填物质化学式);
(3)在⑧与⑨的单质中,氧化性较强的是(填名称)。
(4)用电子式表示元素③与⑧形成化合物的过程。
(5)分别写出⑥元素的氢化物:
a.燃烧的化学方程式,
b.与氯气在光照条件下反应,生成类似甲烷分子结构(正四面体)的氯代烃的化学方程式:。
(6)写出工业冶炼⑤的化学方程式:
(7)上述哪些元素可以从海水中通过一定的方法提取: ,(填元素符号)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的化学方程式; 。