现有常温下的六份溶液:
①0.01mol • L﹣1 CH3COOH溶液;
②0.01mol • L﹣1 HCl溶液; ③pH=12的氨水; ④ pH=12的NaOH溶液;
⑤0.01mol • L﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01mol • L﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=“)。
(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤______⑥(填“>”“<”或“=“)。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H__________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,平均反应速率v(NO2)为__________mol·L-1·s-1,反应的平衡常数K为_____________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___________100℃(填“>”或“<”)。
(3)100℃时达到平衡后, 继续往容器中通入0.1N2O4 mol,则化学平衡_________(填“左移”、“右移”或“不移动”),达到新平衡时N2O4 的浓度________0.04mol/L。
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为_______。
(2)操作Ⅰ是_________、冷却结晶________、洗涤、干燥。。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因___________________________。
(4)加入Sn粉的作用有两个:①调节溶液pH,②__________________________。
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是___________。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是___________________。
(1)水下发射导弹时常采用一种火箭燃料肼(N2H4)。已知在101kPa时,32.0g液态的N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式为_______________________。
(2)我国科学家在1973年就已经将上述反应设计成燃料电池,该燃料电池的电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:
①正极的电极反应式为_______________________。
②负极的电极反应式为_______________________。
(3)用N2H4做火箭燃料常采用N2O4做氧化剂,反应得到的产物对环境无害,则反应的化学方程式为:______________________。
I、请回答:
(1)H2O2的电子式 。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由 。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( ) C2O42-+ =( )Mn2+ ( ) CO2↑+
II、化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2。请推测并回答:
(1)甲的化学式 。
(2)甲与AlCl3反应得到NaAlH4的化学方程式 。
(3)NaA1H4与水发生氧化还原反应(有H2产生)的化学方程式 。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(即把铁锈转化为铁单质),脱锈(铁锈的成分表示为Fe2O3)过程发生反应的化学方程式为: 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由:
制备过程 ,
验纯方法 。
(1)已知:25℃时,Ksp[Mg(OH)2]=4×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH |
<8.0 |
8.0~9.6 |
>9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
①25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为 。
②25℃时,向该Mg(OH)2饱和溶液中加入适量稀盐酸达平衡后该溶液中c(OH-) , c(Mg2+)(填“增大”“减小”或“不变”) 。
(2)向50 mL 0.018 mol/L的AgNO3溶液中加入50 mL 0.020 mol/L的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①充分反应后,溶液中c(Ag+)= mol/L。
②充分反应后,溶液的pH= 。
(3)如图,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。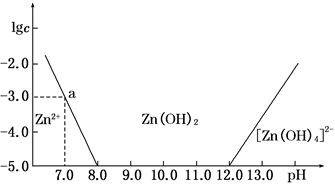
①往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为__________。
②从图中数据计算可得Zn(OH)2的溶度积Ksp=________。
③某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是___________________。