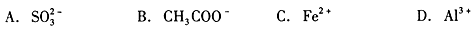用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,密度为ρg•L—1的某气体纯净物一个分子的质量为 |
| B.17g甲基(—14CH3)所含电子数为7NA |
| C.1mol C6H14分子中共价键总数为20 NA |
| D.常温下,0.2molCl2溶于等体积水中,转移电子数为0.2 NA |
下列解释实验事实的方程式不正确的是
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖) 6C + 6H2O 6C + 6H2O |
| B.向AgNO3溶液中加入过量Na2S溶液后,再加入NaCl溶液,黑色沉淀变成白色:Ag2S + 2Cl- =" 2AgCl↓" + S2− |
C.将NH3通入滴有酚酞的水中,溶液变红:NH3 + H2O NH3·H2O NH3·H2O 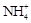 + OH- + OH- |
D.明矾的水溶液pH<7:Al3+ + 3H2O Al(OH)3(胶体) + 3H+ Al(OH)3(胶体) + 3H+ |
化学与社会、生活密切相关,下列说法正确的是
| A.加碘食盐中添加的是碘化钾 |
| B.味觉上具有酸味的食物就是酸性食物 |
| C.Fe3O4俗称铁红,常做红色油漆和涂料 |
| D.晶体硅具有半导体性质,可用于生产计算机芯片 |
往某恒温密闭容器中加入CaCO3,发生反应: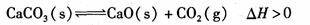
反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是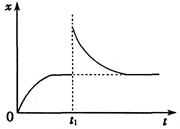
| A.v逆 | B.c(CO2) |
C.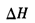 |
D.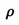 (容器内气体密度) (容器内气体密度) |
实验室中,从海带中提取I2的实验流程如下图所示,下列说法不正确的是
| A.操作①用到的玻璃仪器有:烧杯、玻璃棒、漏斗 |
| B.操作②中需加入氧化剂 |
| C.可以用四氯化碳或酒精代替苯作萃取剂 |
| D.蒸馏I2的苯溶液可获取I2并回收苯 |
分别向含有下列离子的溶液中通入足量NO2气体,数目不会减少的是