X、Y、Z、W、M是五种原子序数依次增大的短周期元素,其中X、Y、M在周期表中的位置如右图所示,又知W的最外层电子数是内层电子数的3倍,试回答下列问题: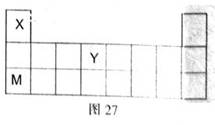
(1)Y在周期中的位置是: ,M的最高价氧化物的水化物电子式为: 。
(2)由这五种元素中的两种元素形成的既含极性共价键又含非极性共价键的化合物有很多种,请写出其中两种四原子分子的结构式: 、 。
(3)由这五种元素形成的单质或化合物中,能与水发生化学反应的有多种,请任写出其中一种与水反应后生成一种单质和一种化合物的化学反应方程式 。
(4)在微电子工业中,用Z的气态氢化物甲的水溶液作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境。写出该反应的化学方程式: 。
(5)在合成甲的反应过程中,反应速率与时间的图像如图所示,则在t1-t6时间内的甲的体积分数最小的时刻是 ,t3时刻改变的外界条件是 ,合成甲的反应是 反应(填“吸热”或“放热”)。
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有Si O2、A12O3等杂质)提取Fe2O3。操作讨程如下: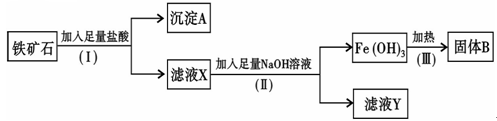
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是;
(2)沉淀A中主要含有 (填化学式),固体B是(填化学式);
(填化学式),固体B是(填化学式);
(3)滤液Y中的阴离子除OH-、Cl-外,还有(填化学式);
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式
(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理:。
(2)炒菜时,经常加入少量的料酒(含乙醇)和醋,可使菜变得香醇可口,用化学方程式表示该反应的原理:。
(3)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式:
(4)CH4与Cl2在光照条件下能生成CH3Cl,写出该反应的化学方程式:
(5)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为:。
为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入答题卡中。
供选择的化学试剂:
| A.酸性高锰酸钾 |
| B.硝酸银溶液和硝酸 |
| C.氢氧化钠溶液 |
| D.无水硫酸铜粉末 |
| 实验要求 |
化学试剂 |
| 检验酒精中是否有水 |
|
| 区别CH4和C2H4两种无色气体 |
|
| 验证味精是否有食盐 |
|
| 除去Fe2O3中的Al2O3 |
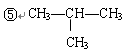
现有下列5种有机物:
①CH3—CH2—CH3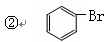
③CH3—CH=CH —CH3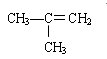
请回答:
(1)其中不属于烃的是(填序号,下同),与①互为同系物的是,与③互为同分异构体的是。
(2)用系统命名法给④命名,其名称为。
现有下列4种物质:① Cl2、② NO、③ Na2O2、④ Na2SO4溶液。其中,可用向上排空气法收集的气体是(填序号,下同) ;常温下为无色的气体是;与CO2反应产生的气体能使带火星木条复燃的是;加入BaCl2溶液产生白色沉淀的是。
;常温下为无色的气体是;与CO2反应产生的气体能使带火星木条复燃的是;加入BaCl2溶液产生白色沉淀的是。