下列各组中化合物的性质比较,不正确的是
| A.碱性:NaOH>Mg(OH)2>Al(OH)3 | B.非金属性:F < O < S |
| C.稳定性:PH3>H2S> HCl | D.酸性:HClO4>HBrO4>HIO4 |
合成氨反应:N2(g)+3H2(g) 
 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图: 下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图: 下列说法正确的是( )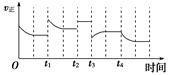
| A.t1时降低了温度 | B.t2时使用了催化剂 |
| C.t3时增大了压强 | D.t4时降低了温度 |
2SO2(g)+O2(g) 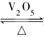 2SO3(g)是制备硫酸的重要反应。下列叙述正确的( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的( )
| A.催化剂V2O5不改变该反应的逆反应速率 |
| B.增大反应体系的压强,反应速率一定增大 |
| C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为 v= |
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量 一定低于反应物总能量
一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C .应用盖斯定律,
.应用盖斯定律, 可计算某些难以直接测量的反应焓变
可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g)。平衡时测得A
zC(g)。平衡时测得A 的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
| A.x+y<z | B.平衡向逆反应方向移 动 动 |
| C.B的转化率降低 | D.C的体积分数下降 |
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓 度不再发生变化
度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ |
| C.②③ | D.③④ |