写出下列物质或微粒的电子式
① H Na+ Cl-
②H2O HCl MgCl2
下表是元素周期表的一部分,回答有关问题。
| ⅠА |
ⅡА |
ⅢА |
ⅣА |
ⅤА |
ⅥА |
ⅦА |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
11 |
12 |
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写)—、最活泼的非金属元素是、最不活泼的元素是
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写)、碱性最强的是,呈两性的氢氧化物是,写出三者之间两两相互反应的离子方程式
(3)在这些元素中,原子半径最大的是—、原子半径最小的是(均用元素符号填写)
(4)写出②与④形成化合物的电子式;写出①单质的电子式;
前20号元素A、B、C、D,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1) B元素的原子结构示意图;
(2)C在周期表中的位置;
(3)化合物D2C的电子式__;
(4) B的氢化物的水溶液加入B的最高价氧化物对应水化物的稀溶液,反应的离子方程式为:;
(5)有人认为,A单质是一种优质能源,你认为它作为能源的优点是:
【化学——选修有机化学基础】
下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
根据上图回答问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为。
(2)化合物B不能发生的反应是(填字母序号):
a.加成反应 b.取代反应 c.消去反应 d.酯化反应 e.水解反应 f.置换反应
(3)反应②的化学方程式是。
(4)C分子中的官能团名称是;A的结构简式是。
(5)同时符合下列三个条件的B的同分异构体的数目有个。
Ⅰ.含有间二取代苯环结构Ⅱ.属于非芳香酸酯Ⅲ.与 FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式。
【化学-物质结构与性质】
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式。
②根据电子云的重叠方式判断:N2分子中存在的σ键和π键数目之比为:。
某短周期元素原子最外层电子数为次外层的2倍,其单质甲可发生:
甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为。
② NO2可作火箭重要燃料—肼(N2H4)的助燃剂。N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1,2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=—1135.7 kJ·mol-1,写出肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:。
(2)若丙为SO2。①把乙滴入硫酸铜晶体,观察到的现象是。
②完成SO2使KMnO4褪色的离子方程式:MnO4- +SO2 +=Mn2+
+SO42- +H+
③一定条件下:2SO2(g)+O2(g)  2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是
2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是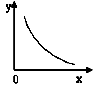
a.x表示温度,y表示n(SO2) b.x表示压强,y表示SO2的转化率
c.x表示n(SO2),y表示n(O2) d.x表示n(SO3),y表示化学平衡常数K