(10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是 。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
| 成分 |
|
|
|
| 质量/g |
|
|
|
(2)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度___ __(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 。
(2)如果没有B装置,C中发生的副反应有 。
(3)甲同学检查完装置气密性良好后进行实验,发现NaNO2的纯度较低。乙同学对上述装置进行适当改进后提高了NaNO2的纯度,其改进措施是 。
(4)丙同学对B中的药品进行了更换,也提高了NaNO2的纯度。丙更换的药品最好是 。
【实验Ⅱ】测定甲、乙同学制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
| 试管编号 |
① |
② |
③ |
④ |
⑤ |
| NaNO2含量/mg·L—1 |
0 |
20 |
40 |
60 |
80 |
b.分别称量0.10 g甲、乙制得的样品溶于水配成500 mL溶液,贴上标签甲、乙。再分别取5 mL甲、乙待测液,各加入1 mL M溶液,均加蒸馏水至10 mL振荡,分别与标准色阶比较。
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同。则甲同学制得的样品中NaN02的纯度是 %。
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
| 实验方案 |
实验现象 |
实验结论 |
| 维生素C可以有效降低NaNO2含量 |
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)。
| Fe3+ |
Fe2+ |
Zn2+ |
|
| 开始沉淀的pH |
1.1 |
5.8 |
5.9 |
| 沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:
(1)由不溶物E生成溶液D的离子方程式为______________________________。
(2)加入ZnO调节pH=a的目的是___________________,a的范围是 。
(3)检验滤液D中不存在铁离子的实验操作是 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是______。
A.ZnOB.NaOH C.Na2CO3D.ZnSO4
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2,I2+2S2O32-=2I-+S4O62-。
①胆矾晶体的纯度为_________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会________(填“偏高”、“偏低”或“不变”)。
[实验化学]苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下: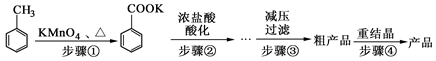
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
在水中溶解性 |
| 甲苯 |
-95 |
110.6 |
0.8669 |
难溶 |
| 苯甲酸钾 |
121.5~123.5 |
 |
 |
易溶 |
| 苯甲酸 |
122.4 |
248 |
1.2659 |
微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 (填“上”或“下”)层;实验操作的名称是 。
(2)步骤②用浓盐酸酸化的目的是 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 。
(5)重结晶时需要趁热过滤,目的是 。
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下: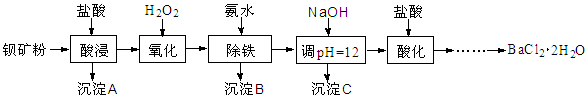
(1)酸浸反应的主要离子方程式为 。
(2)沉淀B主要成分为 ;沉淀C的主要成分是Ca(OH)2和Mg(OH)2。
由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。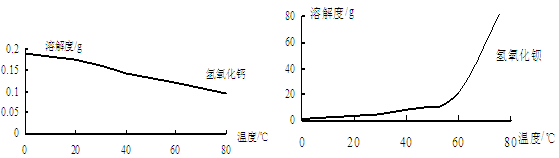
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3: ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
③有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
某化学探究小组拟用废铜屑制取Cu(NO3)2,并探究其化学性质。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。
(1)写出铜与浓硝酸反应的离子方程式 。
(2)①装置中NaOH溶液的作用是 。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、 、过滤。
③你认为此装置是否合理,并说明原因 。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是 。
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为 。
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
| 实验序号 |
1 |
2 |
3 |
4 |
| 温度/℃ |
35 |
50 |
70 |
95 |
| 样品颜色 |
深蓝色 |
深蓝色 |
浅绿色 |
暗蓝色 |
| 样品中碱式碳酸铜 的质量分数/% |
90.9 |
92.7 |
x |
92.0 |
(4)滤液中可能含有CO32—,写出检验CO32—的方法 。
(5)95℃时,样品颜色发暗的原因:____ 。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是 。