某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。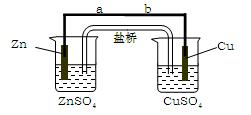
 按照实验步骤依次回答下列问题:
按照实验步骤依次回答下列问题:
⑴导线中电子流向为 (用a、b 表示)。
⑵写出装置中锌电极上的电极反应式: ;
⑶若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(不许用“NA”表示)
⑷装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+ 向右侧烧杯移动、Cl-向左侧烧杯移动
向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
⑸若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
甲同学实验中选用的物质名称为:A____________,B__________,C____________;
C处反应的离子方程式为________________________ 。
写出乙同学的实验中圆底烧瓶中发生反应的化学方程式______________________ ,
A处反应的离子方程式为_________________________;B处的实验现象为 ___________________________。
(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题: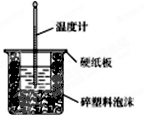
①从实验装置上看,图中尚缺少的一种玻璃用品是。
②大烧杯上如不盖硬纸板,求得的中和热数值将________ (填“ 偏大”“偏小”或“无影响”)。
(2)酸碱中和滴定是中学化学常见实验。
某学校化学课外小组用0.2000 mol·L-1盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
①滴定过程中,眼睛应注视。
②在铁架台上垫一张白纸,其目的是。
③根据下表数据,计算被测烧碱溶液的物质的量浓度是mol·L-1。(保留四位有效数字)
④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果_______。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题: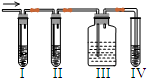
(1)实验室制备乙烯的反应方程式是:
(2)I、II、III、IV装置可盛放的试剂是I;II;III;IV。(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(3)能说明SO2气体存在的现象是。(4)使用装置II的目的是。
(5)使用装置III的目的是。(6)确定含有乙烯的现象是。
已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g · cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)反应原理是___________________________________________________________
(2)在装置C中应加入,(填正确选项前的字母)其目的是_______________
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是;
(4)若产物中有少量副产物乙醚.可用的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
⑴将准确称取的4.23g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有、。
⑵取10.00mL待测液:用经过(填写操作名称)的碱式滴定管量取至锥形瓶中,并加入2-3滴甲基橙。
⑶用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的,右手不停地向同一方向摇动锥形瓶,两眼注视,直到为止,可判断滴定到达终点。
⑷根据下列数据,烧碱的纯度为。
| 滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
⑸判断上述标准酸滴定待测碱的过程中,下列操作引起的误差(填"偏大"、"偏小" "无影响"或"无法判断")
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用待测液润洗锥形瓶
④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁