用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
⑴将准确称取的4.23g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
⑵取10.00mL待测液:用经过 (填写操作名称)的碱式滴定管量取至锥形瓶中,并加入2-3滴甲基橙。
⑶用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的 ,右手不停地向同一方向摇动锥形瓶,两眼注视 ,直到 为止,可判断滴定到达终点。
⑷根据下列数据,烧碱的纯度为 。
| 滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
⑸判断上述标准酸滴定待测碱的过程中,下列操作引起的误差(填"偏大"、"偏小" "无影响"或"无法判断")
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用待测液润洗锥形瓶
④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
实验室里需要纯净的氯化钠溶液,但现只有含硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案提纯: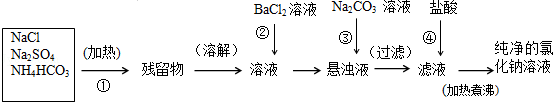
写出有关反应的化学方程式:
第①步
第②步
第③步
第④步 .
亚硝酸盐是一种常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计,假定食品本身不参与反应),某研究小组设计了如下实验方案:
(1)实验过程中需配制500 mL 0.0010 mol/L (NH4)2Fe(SO4)2标准溶液,如下图所示的仪器中肯定不需要的是 (填序号),配制上述溶液还需要用到的玻璃仪器是 (填仪器名称)。配制溶液时,定容的操作方法是 。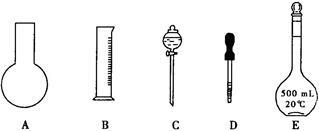
(2)已知亚硝酸钠(NaNO2)的水溶液呈弱碱性,则亚硝酸的电离方程式为 .
(3)完成并配平实验方案中反应①的离子方程式,并用单线桥表示电子转移的方向和数目:
□MnO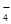 + □ NO
+ □ NO + □
+ □  □ Mn2+ + □ NO
□ Mn2+ + □ NO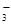 + □ ,
+ □ ,
(4)若称取样品a g进行测定,准确量取12.00 mL 0.0005 mol/L的酸性KMnO4溶液(过量)与溶液
A反应。反应后溶液用0.0010 mol/L (NH4)2Fe(SO4)2 标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则1 kg样品中 NaNO2的质量为_______mg (用含a的代数式表示).
已知Fe2O3与H2反应会因温度不同而可能生成Fe3O4。某兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是_______________________。
(2)乙同学先将少量黑色粉末X放入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4 .
①滴加KSCN溶液的目的是__________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示)______________________。
(3)丁同学的实验方案
操作Z是_________. 通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为___________。
(4)若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程
式为 。
下图为配制0.2mol·L-1Na2CO3溶液250mL示意图。
回答下列问题:
(1)①中应称取Na2CO3_____________g。
(2)图8的操作名称 。
(3)玻璃棒在②、③两步中的作用分别是_____________、_____________。
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视_____________;
B.没有进行操作步骤④和⑤_____________;
C.在第⑤步不慎有少量液体流到容量瓶外_____________。
某化学课外小组用右图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。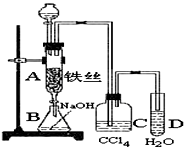
(1)写出A中反应的化学方程式
(2)实验结束时,打开A下端的活塞,让反应液流入B中, 充分振荡,目的是 。
(3) C中盛放CCl4的作用是 。
(4)为证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入 ,现象是 ,则能证明该反应为取代反应。另一种验证的方法是向D中加入 ,现象是 。