海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: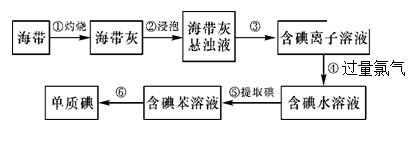
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
A.烧杯 B.表面皿 C.坩埚 D.酒精灯 E.圆底烧瓶
(2)请写出步骤④中反应的离子方程式:
(3)步骤⑥是从含碘的苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出并改正下列实验装置中的错误之处(至少两处)。
①
②
(4)步骤⑤中,某学生选择用苯来提取碘,其验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将分液漏斗上口倒出上层溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。就此实验,完成下列填空:
①正确操作步骤的顺序是 → → →A→G→ →E→F
②上述(G)步骤操作的目的是
③能选用苯从碘水中萃取碘的原因是
(每空3分共计21分)
某学习小组用图示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 (填“偏大”“偏小”或“不受影响”)。
(10分)某化学活动小组设计如图所示装置(部分夹持装置已略去)实验,以探究潮湿的Cl2与Na2CO3反应的产物。
(1)写出装置A中发生反应的化学方程式:________ _____________。
(2)写出试剂Y的名称:__________________ _________________。
(3)将C中反应后的固体物质分成两等份分装于两支试管中,
①向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,写出产生此现象的离子方程式:________ ____________;由此现象推断固体产物中含有______ ____(填化学式,下同);
②向另一支试管中滴加过量的稀硝酸,有无色无味的气体产生,溶液澄清,再向溶液滴加过量的AgNO3溶液,溶液变浑浊,经过滤、洗涤、干燥,得到14.35g固体,由此现象推断固体产物中含有____ ____
(4)已知C中有0.1molCl2参加反应,D中收集到的气体是氯的一种氧化物,由(4)中现象及数据可推知,C中反应的化学方程式为________ ___________。
(8分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________。(提示,高锰酸钾的还原产物为Mn2+)
(2) B装置的名称是__________;A装置中的固体可能是________。
(3)通入C装置的两根导管左边较长、右边较短,目的是__________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________
某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有(填仪器名称);操作II必须用到的仪器是。(填字母)
| A.50ml烧杯 | B.50ml量筒 | C.100ml量筒 | D.25ml滴定管 |

⑵再加入氨水的离子方程式为。
⑶检验沉淀是否洗涤干净的操作是
。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,则接下来还应进行的操作是。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干燃烧称量即可,请你评价是否可行?。(填“可行”或“不可行”)
四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,通过如下实验可以鉴别出该四种溶液,请根据实验步骤填写下列空白:
在四支试管中分别取四种溶液各1mL,。
(1)在四支试管中分别滴入,出现现象的是,离子方程式是。
(2)在剩余三支试管中分别滴入,出现现象的是,离子方程式是。
(3)在剩余两支试管中分别滴入,出现现象的是,离子方程式是。三次实验中都没有明显现象的是。