(每空3分共计21分)
某学习小组用图示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 (填“偏大”“偏小”或“不受影响”)。
(14分)某校进行化学实验考查时,教师给了同学们一小包黑色粉末,这种黑色粉末可能是氧化铜、炭粉或者是这两种的混合物,让同学们通过实验探究来确定。某同学探究过程如下:
(1) 提出假设:
假设1:黑色粉末是炭粉;
假设2:黑色粉末是氧化铜;
假设3:_________________________________________________________________。
(2) 设计实验方案:
他对实验做了如下设想和分析:取少量黑色粉末于烧杯中,并加入过量的稀硫酸。则实验中可能出现的现象与对应结论如下表,请你完成下表。
| 实验中可能出现的现象 |
结论 |
| ① |
假设1成立 |
| ② |
假设2成立 |
| ③ |
假设3成立 |
(3) 进行实验:通过实验及分析,确定该黑色物质为炭粉和氧化铜的混合物。
(4) 拓展:为了进一步探究炭粉和氧化铜的性质,他又利用这种混合物补充做了如下实验,将此黑色粉末隔绝空气加热(若炭完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。请完成下列各题:
①烧杯中________(填“有”或“无”)不溶物;
②若静置后溶液呈无色,则该溶液中溶质是________(写化学式);
③若静置后溶液呈蓝色,该反应的化学方程式为:
________________________________________________________________________。
乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理是

(1)图甲和乙是两套实验室制乙醚的装置,选装置最合适,
理由是______________________________________________________ _____。
(2)反应液中应加入沸石,其作用是。
(3)反应中温度计水银球的位置是 __________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是,除去这种杂质的简易方法是。
拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
| 气体 |
a |
b |
c |
d |
| Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
| NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
| NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)写出制取Cl2的化学方程式________________________。
写出制取NO的化学方程式________________________。
(2)上述方法中可以得到干燥、纯净的气体是。
(3)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体,理由是。
②气体,理由是。
③气体,理由是。
硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式,实验用到的仪器如下图所示:
 |
【提出猜想】
I.所得气体的成分可能只含_________一种;
II.所得气体的成分可能含有__________二种;
III.所得气体的成分可能含有SO2、SO3、O2三种。
【实验探究】
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,行仪器接口连接顺序为__________(填序号);
(2)若实验结束,B中量筒没有收集到水,则证明猜想__________正确;
(3)实验过程,仪器C的作用是 ________________________;
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
请通过计算,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
①组_________________________________________________________________;
② 组_______________________________________________________________。
某研究小组探究SO2和Fe(NO3)3溶液的反应。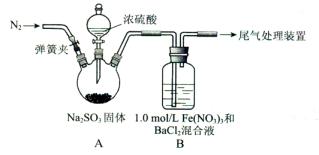
已知:1.0 mol/L的Fe(NO3)3溶液的pH=l
请回答:
(1)装置A中反应的化学方程式是____________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是____________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
观点1.____________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①按观点2,装置B中反应的离子方程式是___________,为证明该观点应进一步检验生成的新物质,其实验操作及现象是__________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)____________。
a.0.1 mol/L稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液