某研究小组探究SO2和Fe(NO3)3溶液的反应。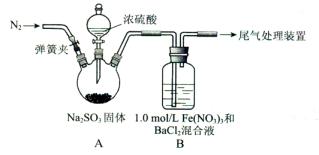
已知:1.0 mol/L的Fe(NO3)3溶液的pH=l
请回答:
(1)装置A中反应的化学方程式是____________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是____________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
观点1.____________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①按观点2,装置B中反应的离子方程式是___________,为证明该观点应进一步检验生成的新物质,其实验操作及现象是__________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)____________。
a.0.1 mol/L稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
【2015北京理综化学】为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用下图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
【2015北京理综化学】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
【2015新课标Ⅱ卷理综化学】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
【2015山东理综化学】(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为_____________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
【2015安徽理综化学】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| Al_____Si |
N____O |
金刚石_____晶体硅 |
CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。