【2015新课标Ⅱ卷理综化学】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)

| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
下图A~D是中学化学实验中常见的几种温度计装置示意图。
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C的空格中(多选要倒扣分)。</PGN0045B.TXT/PGN>
①酒精和浓硫酸混合加热制乙烯
②电石跟水反应制乙炔
③分离苯和硝基苯的混合物
④苯跟溴的取代反应
⑤石油的分馏实验
⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度
⑧食盐和浓硫酸混合加热制氯化氢。
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是____。
要使含K+、Ba2+、Al3+、Fe3+、Ag+的硝酸盐混合溶液进行分离并制成各自阳离子的硝酸盐溶液,现设计如下分离过程。所加入的试剂可从以下选用,氨水、NaOH、K2CO3、KOH、NaHCO3、HNO3、CH2OH(CHOH)4CHO。
(1)请将上述实验步骤中所选用的试剂分子式和各种固体与滤液的成分(离子符合或分子式)填写在下表中。
(2)
(2)写出上述实验过程中步骤①~⑤的离子方程式。____。
在6个集气瓶里分别盛有Cl2、N2、O2、CO2、NO2、NO等气体,试用最简单方法把它们鉴别出来。
答:__ __。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、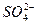 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下: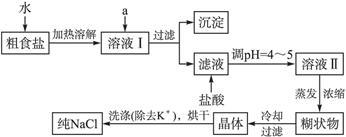
提供的试剂:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、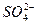 离子,选出a所代表的试剂,按滴加顺序依次为______________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为______________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为______________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有______________(填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2_______(填“>”“=”或“<”)2 L,原因是______________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为______________。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置: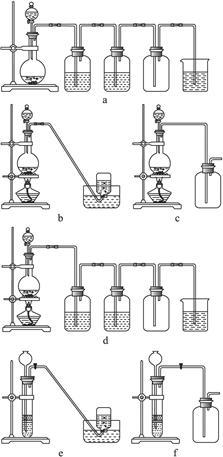
某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。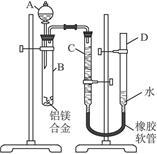
(1)A中试剂为__________________________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性,上述操作的顺序是________________;(填序号)记录C的液面位置时,除视线平视外,还应___________。
(4)B中发生反应的化学方程式为________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________________________________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将__________(填“偏大”“偏小”或“不受影响”)。