【2015安徽理综化学】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| Al_____Si |
N____O |
金刚石_____晶体硅 |
CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO2,其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如下图B装置中所得100mL溶液中取出25.00ml溶液,用0.1mol/L的NaOH溶液滴定,用酚酞作指示,滴定前后的滴定管中液面的位置如上图所示,在B容器中生成硝酸的物质的量为,则Ag与浓硝酸反应过程中生成的NO2的物质的量为。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用装置进行Ag与浓硝酸反应实验,选用的理由是。
②在读取量筒内液体体积之前,应进行的操作。
(3)气体成分分析
若实验测得NO的体积为112.0ml(已折算到标准状况),则Ag与浓硝酸反应的过程中(填“有”或“没有”)NO产生,作此判断的依据是。
(14分)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将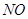 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化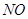 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与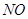 反应,能与
反应,能与 反应
反应
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前先检验装置的气密性,再加入药品,打开弹簧夹后
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
| A.加热该绿色溶液,观察颜色变化 |
| B.向该绿色溶液中通入氮气,观察颜色变化 |
| C.加水稀释绿色溶液,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
(14分)某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
2NH3 + 3CuO 3Cu + N2 +3H2O
3Cu + N2 +3H2O
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成:Cu2+和Cu:Cu2O + 2H+ ="=" Cu2+ + Cu +H2O
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是。
| A.加热氯化铵固体,再通过碱石灰 |
| B.在N2和H2的混合气体中加入铁触媒,并加热至500℃,再通过碱石灰 |
| C.加热浓氨水,再通过碱石灰 |
| D.在生石灰中加入浓氨水,再通过浓硫酸 |
(2)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是。
(3)当观察到 (填现象),即表明A中的反应已经完成。
(4)该小组欲用体积比为1︰4的稀硫酸做试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1︰4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 。
可证明还原产物中含有Cu2O的操作及现象是。
(5)请写出A中生成Cu2O的化学方程式。
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是。
甲、乙两同学欲分别完成“钠与氯气反应”的实验。
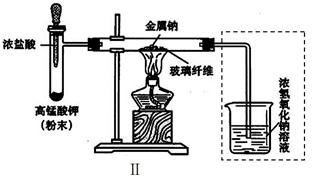

Ⅰ.甲同学的方案为:取一块绿豆大的金属钠(除去氧化层),用滤纸吸净煤油,放在Ⅰ石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶抽去玻璃片后倒扣在钠的上方(装置如图Ⅰ)。该方案的不足之处有_____________。
Ⅱ.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为;待整套装置中后,点燃酒精灯。
(2)点燃酒精灯后,玻璃管中出现的现象是。
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积。
①为提高测量的准确性,图Ⅲ量气管装置中的液体可用;收集完气体后并读数,读数前应进行的操作是冷却至室温并。
②若未冷却至室温立即按上述操作读数,则会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)
③ 如果开始读数时操作正确,最后读数时俯视右边量气管液面,会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
I、“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下图甲是对课本有关Na2O2某性质的两个实验的改进。
(1)将胶头滴管中的水滴入小试管,然后在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是,。
(2)写出甲中反应的离子方程式。
Ⅱ、Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
步骤1:按图乙组装仪器(图中夹持仪器省略),检查气密性,装入药品;
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称;B装置的作用是。
②必须检验氢气纯度的原因是。③设置装置D的目的是。
④你得到的结论是(若能反应请用化学方程式表示)。