(1)某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液。

请回答:
① 乙醇与乙酸制取乙酸乙酯的反应类型是 。
② 若用18O标记乙醇中的氧原子,则CH3CH218OH与乙酸反应的化学方程式是 。
③ 球形干燥管C的作用是 。
④ D中选用饱和碳酸钠溶液的原因是 。
⑤ 反应结束后D中的现象是 。
(2)下列叙述正确的是 (填字母)。
| A.向碘水中加入酒精,萃取碘水中的碘 |
| B.液化石油气、汽油和石蜡的主要成分都是碳氢化合物 |
| C.用淀粉水解液做银镜反应,若有银镜产生,则证明淀粉部分水解 |
| D.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯 |
E.为证明溴乙烷中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热;冷却后,加入稀硝酸至溶液呈酸性,滴入AgNO3溶液观察是否有淡黄色沉淀生成
一学生在实验室测某溶液pH。实验时他先用蒸馏水润湿pH试纸,然后
用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作是否导致实验结果一定有误差?答:。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是,原因是
另一同学用正确的方法测定NH4Cl溶液的pH﹤7,用离子方程式表示原因:
。
草酸晶体的组成可用H2C2O4·XH2O表示,为了测定x值进行如下实验:
①称取Wg草酸晶体,配成100. mL水溶液
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后, 用浓度amol/L的KMnO4溶液滴定,所发生的反应为:
用浓度amol/L的KMnO4溶液滴定,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O ;
试回答:
(1)实验中不需要的仪器有(填序号)还缺少的仪器有(填名称).
a托盘天平(带砝码,镊子) b滴定管 c 100mL量筒 d 100mL容量瓶
e烧杯 f漏斗 g锥形瓶 h玻璃棒 i药匙 j烧瓶 k滴定管夹
(2)实验中KMnO4溶液应装在式滴定管中,达到滴定终点的现象是
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会(偏大、偏小、无影响)。
(4)在滴定过程中若用去amol/L的KMnO4溶液VmL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为mol/L,由此可计算X的值是.
(5)若滴定终点读数时俯视,则计算的X值可能会(偏大、偏小、无影响)
某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。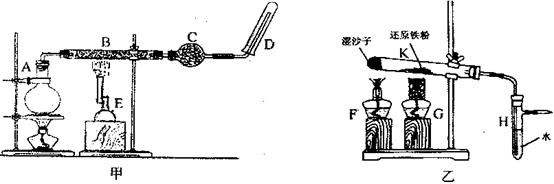
已知B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。
Ⅰ.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?。
(2)乙装置中湿沙子的作用是。
(3)B处发生反应的化学方程式:。
(4)该同学认为欲在乙 装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是。
装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是。
(5)对比甲、乙两装置的B和K,B的优点是。
Ⅱ.某同学为了研究一定时间内铁粉的转化率,用上图中的甲装置设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算铁粉的转化率。
①用排水法收集并测量气体体积可选下图中的装置。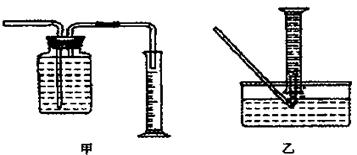
②称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可)。
③为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入足量的盐酸,溶解后过滤,立即向溶液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是:。
(共10分)分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为,
(2)装置C的直玻管中发生的反应的化学方程式为,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是,
(4)装置E中NaOH的作用是,反应的离子方程式为;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________; __________________________________。
为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。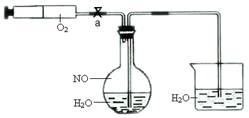
(1)打开止水夹a ,推动针筒活塞,使O2进入平底烧瓶。关上止水夹a ,首先观察到烧瓶中的现象:,
产生此现象的化学反应方程式为:。
(2)轻轻摇动平底烧瓶,观察到烧瓶中的现象为:
①
②
产生此现象的化学反应方程式为 ______________。