(10分)A~G各物质间的关系如下图,其中B、D为气态单质。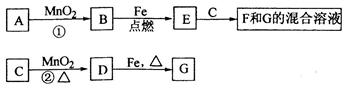
请回答下列问题:
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;
若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_______________________________________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________, 实验现象为_____________________________________________。
实验现象为_____________________________________________。
如图所示的原电池装置中,锌为极,电极发生的是反应(填氧化或还原),电极反应式为;铜电极反应式为,铜片上观察到的现象为。
已知A、B、C、D、E是短周期的五种元素,它们的原子序数依次增大。A是短周期元素中原子半径最小的元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为淡黄色晶体。
(1)写出E元素在周期表中的位置;
(2)写出C元素的离子结构示意图;
(3)写出化合物A2B的电子式;
(4)写出C、D的最高价氧化物对应水化物相互反应的化学方程式:。
(1)写出乙醛和银氨溶液发生反应的化学方程式:。
(2)写出葡萄糖发酵制乙醇化学反应方程式:___________ ______ _____________。
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。根据以上所给的数据计算反应:
2H2(g)+O2(g)=2H2O(g) ;△H = 。
(2)如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为H2SO4溶液时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
①酸式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
②碱式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
如图所示表示的是电解饱和食盐水的装置,阴极材料、阳极材料都是碳棒,饱和食盐水中含有少量酚酞。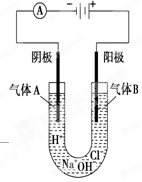
(1)接通电源后,饱和食盐水中的阳离子的移动方向是:向极移动。
(2)电极上生成了气体A和B,生成气体A的电极反应式是 。
(3)随着气体的生成,饱和食盐水中产生了两种不同的颜色:一种是 色,其产生的位置是 (填“阴极区”或“阳极区”);另一种是 色,其产生的位置是 (填“阴极区”或“阳极区”)。