下表是甲、乙、丙、丁四种有机物的有关信息;
| 甲 |
①能使溴的四氯化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成丙 ③能与水在一定条件下反应生成丙 |
| 乙 |
①由C、H两种元素组成;②球棍模型为 |
| 丙 |
①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与丁反应生成戊 |
| 丁 |
①由C、H、O三种元素组成;②球棍模型为 |
根据表中信息回答下列问题:
(1)写出与甲互为同系物,且比甲多一个碳原子的有机物在一定条件下生成的高分子化合物的结构简式 ;
(2)乙与液溴反应的化学方程式为 ;
(3)丙与丁反应能生成戊,戊为相对分子质量为100的酯,该反应类型为 ,其化学反应方程式为 ;(4)写出一种符合下列条件的戊的同分异构体的结构简式: ;
I.分子中不含支链并能使溴的四氯化碳溶液褪色
II.能与NaHCO3溶液发生反应
学校附近的湖水中浮萍疯长,助长水质恶化。湖水水样中可能含有Fe3+、Ba2+、K+、H+、NO3-、Cl-、CO32-、SO42-离子。为了进一步确认,取样进行实验检测:
①取水样仔细观察,呈透明、均一状态。
②用pH试纸测定污水的pH,试纸显红色。
③向水样中滴入KSCN溶液,呈红色。
④向水样中滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(1)由此可知,该污水中肯定含有的离子是_________,肯定没有的离子是_________。
(2) 浮萍疯长的可能原因是水中含有较多的_____________离子。
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的最高正价与最低负价的代数和为2,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为、、_。
(2)选用以上元素组成一种离子化合物,该化合物为______。
(3)X和Y组成的化合物Q中,既含有极性共价键又含有非极性共价键,Q的分子式是。Q在空气中点燃时,迅速而安全的燃烧,其反应产物没有任何污染,燃烧时的化学方程式为;Q还可将酸性工业废水中的Cr2O72-还原为Cr3+,氧化产物为常见气体。相应的离子方程式为。
氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。
(1)以上元素在海水中的存在形态是___________(选填①游离态②化合态③不确定)
(2)以下变化属于化学变化的是__________________________:
①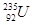 发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
发生核裂变,②重氢(2H)发生核聚变,③LiH做野外生氢剂,④海水晒盐
(3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式_____________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式__________________________________。
(4)工业由氯化钠制取金属钠的化学方程式为____________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_______________________
(5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为_______________。
硫及其化合物在自然界普遍存在、容易转化。
Ⅰ.火山喷发、生物质降解时产生的有毒气体H2S、SO2等进入大气后,因一些自然转化而得以消除。如
(1)H2S和SO2分子碰撞时,污染会降低。反应方程式为_________________________。
(2)H2S在常温下,会被空气逐渐氧化,反应方程式为_________________________。
(3)SO2在飘尘催化下,会被空气氧化为SO3,遇水生成硫酸,硫酸遇石灰岩转化为稳定的石膏矿物(CaSO4·2H2O)。SO2被氧化的化学方程式为_____________________________。
在环保措施上,这会给我们带来“师法自然”的启示。
Ⅱ.人为过度排放二氧化硫等,会超出自然净化吸收能力,带来严重环境污染。“石灰-石膏法”和“烧碱法”是工业上常用的工业烟气脱硫法。
(4)“石灰-石膏法”吸收二氧化硫的流程为:
由SO2等生成石膏的总化学方程式为________________________________________。
(5)“烧碱法”是用氢氧化钠浓溶液吸收含二氧化硫的烟气,其优点是氢氧化钠碱性强、吸收快、效率高。化学方程式为______________________________________。但烧碱的价格较贵(石灰0.36元/kg,烧碱2.90元/kg)。
(6)若将“石灰-石膏法” 和“烧碱法”结合起来对烟气脱硫,则会产生快速高效低成本无污染的好效果,最终仍得到石膏产品。请在下列流程图的①~④处填写物质的化学式: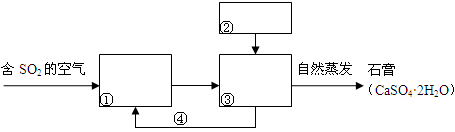
在学习了铜元素的性质之后,小明同学做了H2O2与铜的有关探究实验:
实验一:将铜丝置于装有H2O2溶液的试管中,没有气体产生;加热溶液时,观察到铜丝表面产生大量气体。
实验二:将铜丝置于装有硫酸酸化的H2O2溶液的试管中,溶液迅速变蓝。同时产生大量气体。
请回答下列问题:
(1)上述实验一(加热时)、实验二中铜丝表面均产生了大量气体,该气体是。
(2)写出在酸性条件下H2O2氧化铜丝的离子方程式:。
(3)H2O2能发生多种化学反应,等物质的量的H2O2在仅作氧化剂的反应、仅作还原剂的反应和分解反应中转移的电子数目之比为。
小明同学设计了以废铜屑制取硫酸铜的三个方案:
①认为最佳方案是。
②简述另两个方案的不足之处:。