有A、B、C、D四种元素,其原子序数大小关系为A>B>C>D。已知:将0.5 mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子。当A的单 质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
(1)元素符号:A___▲__,B___▲__,C__▲___,D__▲__。
(2)鉴定某物质中含有B元素的最简单的实验是__▲__。
(3)A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是(用化学式表示)__▲____。
在标准状况下,4g H2,11.2L O2,1mol H2O中,所含分子数最多的是______,含原子数最多的是________,质量最大的是________,体积最小的是________。
19.2gSO2在标准状况下的体积为________L,其中含氧原子的物质的量为________mol,该气体在标准状况下的密度是________。
蛇纹石因其花纹似蛇皮而得名,某地蛇纹石大约含MgO38%,另外除了含SiO2外,还含有CaO、Fe2O3、Al2O3等氧化物,由蛇纹石矿制备MgO的工艺流程如下。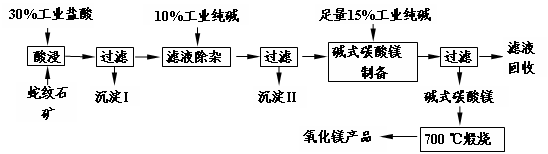
(1)写出酸浸过程中的一个离子方程式。若在实验室进行酸浸过程,需要的仪器有烧杯、。
(2)沉淀I的成分是(写化学式)。写出它的一个用途。
(3)沉淀II的成分是。
(4)从滤液中能回收的物质有。
(5)写出碱式碳酸镁700 ℃煅烧产生氧化镁的化学方程式。
草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格。
| 温度 |
v(H2C2O4) |
v(KMnO4) |
KMnO4褪色时间 |
| 40 ℃ |
10 ml |
10 ml |
40 s |
| 40 ℃ |
20 ml |
20 ml |
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn H++In—。则酸根离子In—的颜色是。甲基橙的酸性与草酸相比,(填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是。甲基橙的酸性与草酸相比,(填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5mol/L,该溶液pH可能是(填字母)。
A.5 B.6 C.7D.9
芳香族化合物A有如下的转化关系:
已知C的结构简式为 ,F能使溴的CCl4溶液褪色。请回答下列问题:
,F能使溴的CCl4溶液褪色。请回答下列问题:
(1)C→E的反应类型是________________。
(2)写出结构简式:A;G。
(3)请写出E→F反应的化学方程式:。
(4)检验B中一种官能团的实验操作是。
(5)若有机物H与D互为同分异构体,则与有机物B互为同系物的H的同分异构体有
种,任写一种符合此条件的H的结构简式。