下面是C60、金刚石和二氧化碳的分子模型。
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________
(2)从晶体类型来看,C60属于_________晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是__________________________;晶体硅中硅原子与共价键的个数比为
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________个二氧化碳分子,二氧化碳分子中 键与
键与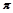 键的个数比为 。
键的个数比为 。
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是_______,丙烯分子中2号碳原子的杂化方式是_______,丙烯分子中最多有 个原子共平面。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: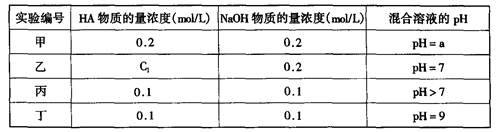
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸;
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是;
| A.前者大 | B.后者大 | C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,HA是酸(选填“强”或“弱”);
该混合溶液中离子浓度由大到小的顺序是;
(4)丁组实验所得混合溶液中由水电离出的c(OH—)=mol/L;
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。c(Na+)-c(A—)=mol/L。
(12分)
(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了。稀释后还需要加入一些铁粉,其目的是,相关反应的离子方程式为。
(2)氯化铁水溶液呈性,原因是(用离子方程式表示):_______________ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答: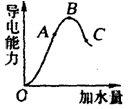
(1)“O”点导电能力为“0”的理由是。
(2)A、B、C三点pH由大到小的顺序是__________________。
(3)A、B、C三点电离度最大的是_____________。
(14分)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是_______________,写出基态Fe原子的核外电子排布式_________________。
⑵血红素中N原子的杂化方式分别为________、________,在下图的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为_________,δ、α两种晶胞中铁原子的配位数之比为____________。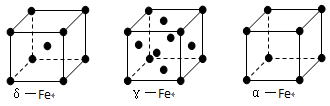
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g)△H1=-393.5 kJ·mol—1①
C(s)+CO2(g) = 2CO(g)△H2=+172.5 kJ·mol—1②
4CO(g )+Fe3O4(s) = 4CO2(g)+3Fe(s)△H3=-13.7 kJ·mol—1③
)+Fe3O4(s) = 4CO2(g)+3Fe(s)△H3=-13.7 kJ·mol—1③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵8 00℃时,C(s)+CO2(g)
00℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)