常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是________(填“强酸”或“弱酸”)。
(2)②组情况表明c_____0.2(填“大于”、“小于”或“等于”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是____________________。
(3)分析第③组实验结果,说明HA的电离程度________NaA的水解程度(填“大于”或“小于”)。该混合溶液中离子浓度由大到小的顺序是____________________________。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
(5)写出①组混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)=________mol·L-1;
c(OH-)-c(HA)=________mol·L-1。
某工业废水中含有CN-和Cr2O72—等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: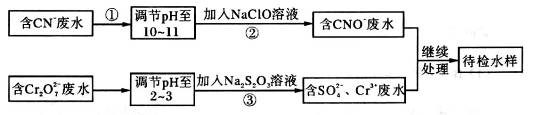
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为________________。
(2)步骤③的反应为S2O32—+ Cr2O72—+H+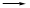 SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________________。
(4)在25℃下,将amol·L—1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=_________________。若25ºC 时Ka=1×10-9则同体积均为0.1mol·L-1的NaCN、HCN的混合溶液中下列说法不正确的是
a.此溶液一定有C(Na+)+C(H+)=C(OH‾)+C(CN‾)
b.混合溶液中水的电离程度一定大于该温度下纯水的电离程度。
c.此溶液一定有C(Na+)="C(HCN)+" C(CN‾)
d.此溶液加入少量氢氧化钠或盐酸溶液的PH值变化不大
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是____________。
(10分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是
(填元素符号或化学式,下同);第一电离能从大到小的顺序是
(2)由A、C两种元素形成的离子化合物中C元素的质量分数为73.68%,它的所有原子最外层都符合相应的稀有气体原子的最外层电子层结构,该物质加热时就能分解为两种气体,则X的化学式为,X受热分解的化学方程式为_____________________。
(3)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为,Y的阴离子是一种弱酸根离子,全由C元素组成,与Y的阴离子具有相同原子数和电子数的分子有(任写一种),Y与盐酸反应的离子方程式为。
(4)(CA4)2SO4溶液加水稀释时,溶液中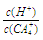 的值将(填“增大”、“减少”或“不变”)。
的值将(填“增大”、“减少”或“不变”)。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中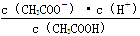 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
在体积不变的2L密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
| t℃ |
500 |
600 |
800 |
900 |
1000 |
| K |
0.5 |
0.6 |
1.0 |
1.3 |
1.5 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应正反应为_____反应(选填“吸热”“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:
3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________。
(4)若800 ℃时,向容器中充入2 mol CO2、2 mol H2,反应进行到5min内,容器内CO的体积分数为20%,则用CO2表示的平均反应速率为,达到平衡后,CO2的转化率为。
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(12分)[物质结构与性质]
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域。下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程。
(1)Ti基态的电子排布式为。
(2)TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃。
固态TiCl4属于晶体。
(3)BaCO3为离子化合物。CO32-中C原子的杂化类型为,写出一种与CO32-互为等电子体的阴离子:
(填化学式)。
(4)钛酸钡的晶胞如图所示,其化学式为。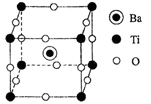
(5)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2•H2O。1mol该配合物中含有σ键的数目为。