某工业废水中含有CN-和Cr2O72—等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
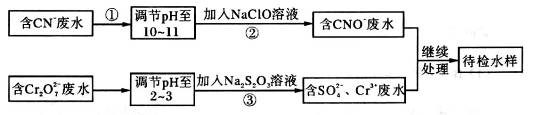
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为________________。
(2)步骤③的反应为S2O32—+ Cr2O72—+H+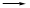 SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________________。
(4)在25℃下,将amol·L—1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=_________________。若25ºC 时Ka=1×10-9则同体积均为0.1mol·L-1的NaCN、HCN的混合溶液中下列说法不正确的是
a.此溶液一定有C(Na+)+C(H+)=C(OH‾)+C(CN‾)
b.混合溶液中水的电离程度一定大于该温度下纯水的电离程度。
c.此溶液一定有C(Na+)="C(HCN)+" C(CN‾)
d.此溶液加入少量氢氧化钠或盐酸溶液的PH值变化不大
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是____________。
写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系 。






 (2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): → → →
(2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): → → → 。
。 (3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。 (4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。
(4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。 (5)装置③中所盛溶液是 ,可验证的产物是
(5)装置③中所盛溶液是 ,可验证的产物是 
硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用得Sz2-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再适入足量的SO2,SO2与Sz2-也完全转化为S2O32-。问:
(1) S+SO2+OH-完全转化为S2O32-的离子方程式____________________
S+SO2+OH-完全转化为S2O32-的离子方程式____________________
(2) amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
(3) 若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为 _________。
_________。
已知盐酸加到品红溶液中,使品红溶液的红色加深。试推测: (1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。
(1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。 (2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。 (3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
(3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
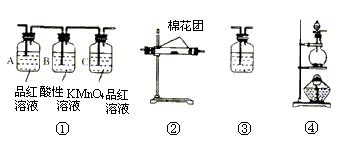
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
实验室模拟合成氨和氨催化氧化的流程如下:





已知实验室可用饱和亚硝酸钠(
)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从上图中选择制取气体的合适装置:
氮气、氢气。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(填"会"或"不会")发生倒吸,原因是:。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:,锥形瓶中还可观察到的现象是:。
(5)写出乙装置中氨氧化的化学方程式:。
(6)反应结束后锥形瓶内的溶液中含有
、
、、离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于上(用以下所给仪器的编号填入,下同),取用坩埚应使用,灼烧后的坩埚应放在上,不能直接放在桌面上。
实验所用仪器:A.蒸发皿 B.石棉网 C.泥三角 D.表面皿 E.坩埚钳 F.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是。
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、、冷却结晶、、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:。
(5)在测定所得胆矾(
)中结晶水x值的实验过程中:称量操作至少进行次。
(6)若测定结果
值偏高,可能的原因是。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化