在a.b两支试管中,分别装上质量相等形状相同的一颗锌粒,然后向两支试管中:
(1)分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。则
a.b两支试管中的现象:相同点是 ;不同点是
反应完毕后生成气体的总体积是a b。
(2)分别加入相同PH、相同体积的稀盐酸和稀醋酸时,两支试管中的反应速率在反应刚开始时是a b(填“大于”、“等于”或“小于”下同),当两种酸都反应完毕后生成气体的体积是a b
(11分) H是一种香料,可用下图的设计方案合成.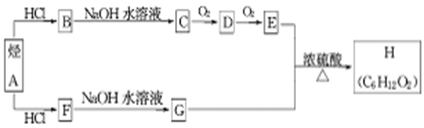
已知:①在一定条件下,有机物有下列转化关系: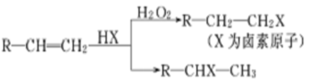
②烃A和等物质的量的HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F。
(1)D的结构简式为________________,其核磁共振氢谱有_____组峰。
(2)烃A→B的化学反应方程式是_______________________________。
(3)F→G的化学反应类型为__________。
(4)E+G→H的化学反应方程式_____________________________________。
(5)H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是____________。(用结构简式表示)
(12分)碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,含氧元素的质量分数为31.58%.A遇FeCl3溶液显紫色,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是______________。
(2)若A能与NaHCO3溶液反应,A的结构简式为_________________;写出A与NaHCO3溶液反应的化学方程式_______________________。
(3)如A可以发生如图 所示转化关系,D的分子式为
所示转化关系,D的分子式为
C10H12O3,A与C反应的化学方程式__________________________
(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度.甲、乙两装置相比较,乙装置有哪些优点__________。
(8分)有机物A的结构简式为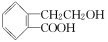 ,它可通过不同化学反应分别制得B、C和D三种物质。
,它可通过不同化学反应分别制得B、C和D三种物质。
(1)B中含氧官能团的名称是________。
(2)A―→C的反应类型是______;A~D中互为同分异构体的是_____。
(3)由A生成B的化学方程式是______________________________。
(1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气L(标准状况下)。导线中通过mol电子。
(2)H、D、T三种原子,在标准状况下,1 mol各单质中,它们的质子数之比是,
(3)含6.02×1023个中子的 Li的质量是g。
Li的质量是g。
现有如下两个反应:
(A)NaOH + HCl="===" NaCl + H2O(B)Zn + CuSO4 = ZnSO4 + Cu
(1)根据两反应本质, 判断能设计成原电池的是。
(2)根据你的选择完成下列问题:
正极材料:;负极材料:
电解质:。
正极反应式为:
负极反应式为: