(8分)有机物A的结构简式为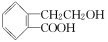 ,它可通过不同化学反应分别制得B、C和D三种物质。
,它可通过不同化学反应分别制得B、C和D三种物质。
(1)B中含氧官能团的名称是________。
(2)A―→C的反应类型是______;A~D中互为同分异构体的是_____。
(3)由A生成B的化学方程式是______________________________。
⑴2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为
⑵人们研究发现第一周期与第二周期一些元素性质与同族元素性质共性很少,有人建议将氢放在ⅦA,写出一种能支持该观点的化合物:,人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的“锂键”,请写出(LiF)2含锂键的结构式:
⑶研究周期表发现存在对角线规则,处在对角线上的元素性质相似,如硼和硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式:
⑴配平反应器中发生的反应方程式:
I2 + KIO3 + H2O="=" KH(IO3)2 + KCl + Cl2↑
⑵步骤②中,用硝酸而不用HI,其原因可能是
⑶步骤③要保持溶液微沸1小时,以完全排出氯气,排出氯气的原因为
⑷合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有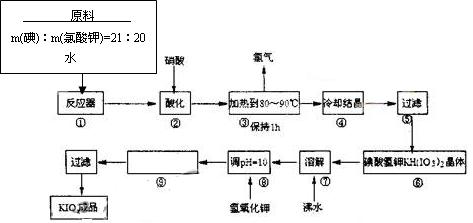
⑸用氢氧化钾调节溶液的PH值,发生的反应方程式为:
⑹参照碘酸钾溶解度曲线,步骤得到碘酸钾晶体,你建议的方法是
| 温度 |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
( 10分 ) 下列6种有机物:
| A.石蜡 | B.蔗糖 | C.甲苯 | D.甘油 E. 四氯化碳 F. 乙醛 |
( 1 ) 水解后产物能发生银镜反应的是 _____________ 。
( 2 ) 能用于制造炸药的是 _____________ 。
( 3 ) 能用作灭火剂的是 ___________ 。
( 4 ) 能从溴水中萃取溴的是 _______________ 。
( 5 ) 能溶解于水的是 ______________ 。
有3种可溶性离子化合物A、B、C,它们分别由阳离子NH4+、Na+、Cu2+ 和阴离子OH-、S2-、SO42-两两结合而成,取质量相等的A、B、C分别溶解于水,配成等体积的溶液,这3种溶液物质的量浓度大小的顺序是B>A>C根据题意回答下列问题:
(1)推断出A是___________,B是___________,C是___________。
(2)室温时C溶液的pH___________7(填>、=、<=)。
(3)写出A与B溶液混合发生反应的离子方程式___________________________;
苯环上原有取代基对苯环上再导入另外取代基的位置有一定影响。其规律是
(1)苯环上新导入的取代基的位置主要决定于原有取代基的性质;
(2)可以把原有取代基分为两类: ①原取代基使新导入的取代基进入苯环的邻、对位;如:-OH、-CH3(或烃基)、-Cl、-Br等;②原取代基使新导入的取代基进入苯环的间位,如:-NO2、-SO3H、-CHO等。现有下列变化:(反应过程中每步只能引进一个新的取代基)
 |
(1)请写出其中一些主要有机物的结构简式:
ABCD
(2)写出①②两步反应方程式:,
21.。