已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:
(1)写出A的电子式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的化学方程式:
① ;
② ;
④ 。
(4)化学课外兴趣小组学生在实验室里制取的A中常混有少量的二氧化硫,老师启发他们设计了如右图实验以确认上述混合气体中有A和SO2。回答下列问题: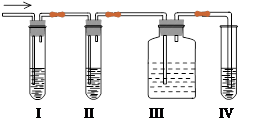
①I、II、III、IV装置可盛放的试剂是I ;II ;III ;IV 。(填字母)
A、品红溶液 B、NaOH溶液 C、浓硫酸 D、酸性KMnO4溶液
②使用装置III的目的是 。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素; ②Y原子价电子排布msnmpn ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z的元素符号为_______,在周期表中的____分区。
(2)向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为___________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有(填序号)。
A配位键 B极性共价键 C 非极性共价键 D 离子键
(3)氢化物的沸点:X的比同族其它元素高的原因是。Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_____(填序号)。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为_______________。R、X、Y四种元素的原子半径由小到大的顺序为________(均用元素符号表示)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为_____。
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为;分子的VSEPR模型名称为;阴离子的立体构型为_____。
(2)G的价电子排布式为。用电子式表示化合物AE2的形成过程。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为 和 (填化学式)。
(4)E有多种含氧酸根①EO-②EO2-③EO3-④EO4-,其中空间构型为四面体型的是。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式)
前四周期元素X、Y、Z、W核电荷数依次增加,并且X、Y、Z的核电荷数之和为32;Y原子基态时被电子占据的轨道有9个,其中6个被电子占满;非金属元素Z的 M层上成对电子与未成对电子所占据的原子轨道数相等;W3+离子的3d轨道中有10个电子。
(1)W基态原子的电子排布式为_____________
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是__________;中心原子的价层电子对数为_______;a分子的立体构型是____________
(3)Z的低价氧化物既氧化性又有还原性,请分别举例说明____ _、_______(写化学方程式)。
(4)Y4分子的键角是。我们还学过了很多与Y4空间构型相同但键角不同的分子,请列举一种分子(写电子式)
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据问题。
(1)下列物质本身具有的能量最低的是 _____(填序号)A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl 2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)A Cl 2<Br2<I2 B Cl 2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是(填序号)
①原子或分子间的相互作用叫化学键
②氯分子中两个氯原子间的距离是键长
③键长的大小与成键原子的半径和成键数目有关
④键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是(填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性,则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个π键。

根据信息回答下列问题:
(1)上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是(名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________、_____________________________
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为_____ ___(用具体元素符号表示)。