(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题:
2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。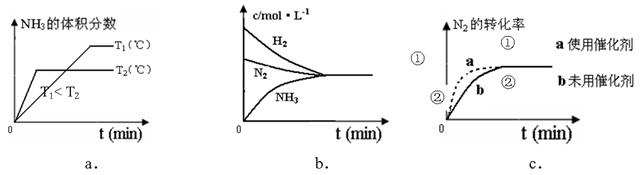
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
现有:①HNO3②SiO2③CaCO3④C2H5OH ⑤CuSO4⑥FeCl3。请你根据所学知识,选择恰当的序号填空:
(1)水溶液呈蓝色的是;
(2)制造玻璃和水泥都需要的原料是;
(3)能溶于水但不属于电解质 的是。
的是。
A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)B2显酸性的原因是(用化学方程式说明) 。
。
某有机物由C、H、O三种元素组成,它的红外吸收光谱表明有羟基O—H键和烃基上 C—H键的红外吸收峰,且烃基和羟基上氢原子个数之比为2:1,它的相对分子质量为62,试写出该有机物的结构简式。
请你按官能团的不同对下列有机物进行分类: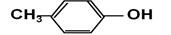

H2O由液态变为气态的过程可以用下式来表示:
H2O(l) H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O
H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O 的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。请回答下面两个问题:
(1)减小压强,平衡向移动。所以高山上由于空气稀薄,水的沸点比平地上
(填高或 低)。高压锅中水的沸点比普通锅中水的沸点(填高或低)。
低)。高压锅中水的沸点比普通锅中水的沸点(填高或低)。