生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。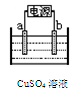
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。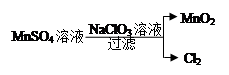
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2b.NH4HSO4c.(NH4)2SO4d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为(填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应)_(结果保留三位有效数字)。
根据可逆反应: +2I-+2H+
+2I-+2H+
 +I2+H2O,设计如下图所示实验装置。B烧杯中装有Na3AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U型管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因相连通而导电。C1、C2棒为惰性电极。进行如下操作:
+I2+H2O,设计如下图所示实验装置。B烧杯中装有Na3AsO4和Na3AsO3溶液,A烧杯中装有I2和KI溶液。两烧杯中用一倒置的装有饱和KI溶液的U型管相连,该装置称为盐桥,其作用是避免两烧杯中的溶液相混合,又能使两烧杯中的溶液因相连通而导电。C1、C2棒为惰性电极。进行如下操作: 
①向A溶液中逐滴加入浓HCl,发现电流计指针发生偏转;
②若改向B溶液中滴加40%的 NaOH溶液,发现电流计指针向相反方向偏转。
试回答以下问题:
(1)两次操作中,可以观察到电流计指针偏转方向相反,为什么?试用化学平衡原理解释之 ;
(2)操作①过程中,C1棒上发生的电极反应式为:,操作②过程中C2棒上发生的电极反应式为:。
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极,阳极。
(1)按系统命名法为下列有机物命名

①,②;
(2)根据名称写出有机物结构简式
2,5-二甲基-4-乙基庚烷;
(3)戊烷(C5H12)的某种同分异构体只有一种一氯代物,试书写戊烷此同分异构体的结构简式: ;
(4)有两种有机物都含有碳92.3%,含有氢7.7%,第一种有机物对氢气的相对密度为13,第二种有机物的蒸气密度为3.49 g/L(已折算成标准状况下的值), 则第一种有机物的结构简式为,第二种有机物的分子式为。
北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式:;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为:,正极反应式为:;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式:。