氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为 ▲ 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 ▲ 。该工艺选择氯气的优点是 ▲ 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为 ▲ mol/L。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛b mL于锥形瓶,加入1滴酚酞,用浓度为C mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为 ▲ mg/L。
已知有一种节能的氯碱工业新工艺,将电解池和燃料电池相组合,相关流程如下图所示(电极未标出):回答下列有关问题: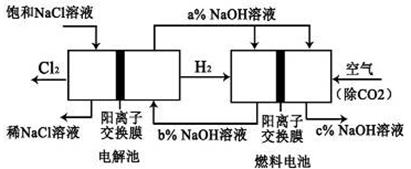
(1)电解池的阴极反应式为 _____________________________________
(2)通入空气的电极为_______________(“正极”或“负极”)
燃料电池中阳离子的移动方向___________(“从左向右”或“从右向左”)。
(3)电解池中产生2 mol Cl2,理论上燃料电池中消耗_____ mol O2。
(4)a、b、c的大小关系为:__________。
(10分)(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线图所示。由图中数据分析,该反应的化学方程式为:______________________________________________________
反应开始至2 min,Z的平均反应速率为__________________。
(2)不同时间测得以下反应速率:①v(X)=0.075mol/(L·min)
②v(Y)=0.001mol/(L·s)③v(Z)=0.06mol/(L·min)
速率由大到小关系正确为:(填编号)
(3)可逆反应:
aA(g)+bB(g)  cC(g)+dD(g)的v-t图像如图所示:
cC(g)+dD(g)的v-t图像如图所示:
①其阴影面积表示的是________________________________
②若其他条件都不变,只是在反应前加入合适的催化剂,则阴影面积将________(填变大、不变或变小)
过渡金属在生产生活中的应用十分广泛。
Ⅰ.Cr元素形成的氯化铬酰(CrO2Cl2)有重要用途,在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
Ⅱ.Cu可形成多种配合物,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生的离子方程式
;
。
深蓝色溶液中配离子的立体构型为。
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3H2O(填“>”、“=”或“<”);
Ⅲ.Ni(CO)6为正八面体结构,其中的镍原子位于正八面体的中心,配位体CO分子则在正八面体的六个顶点上。
(4)若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是。(填字母编号,任填一组。图中黑点为NH3,圆圈为CO,Ni略去)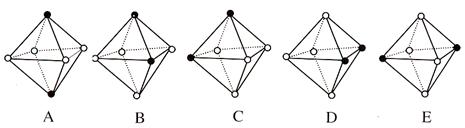
A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图,E—的原子结构示意图。
(2)写出BCD的电子式,E2C的结构式。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式;DC3中心原子杂化方式;
EC4—微粒中的键角;BC32—微粒的键角;
DE2分子的立体构型;B2A2分子的立体构型。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为,π键数目为。
(5)根据等电子原理,指出与BC2互为等电子体的离子(一种即可)
(12分)根据已学知识,回答下列问题:
(1)具有(n-1)d10n s2电子构型的元素位于周期表中区和族。
(2)写出3P轨道上有2个未成对电子的元素名称:。
(3)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素X,该元素的价电子排布式为3d54s1,该元素可与氧元素形成离子X2O72-,K2X2O7氧化浓盐酸生成氯气的同时还生成了X3+,写出该反应的离子方程式。
(4)键能是指气态基态原子形成1 mol化学键释放的最低能量。某些化学键的键能如下表
格所示(单位:kJ·mol-1):
| 键 |
H—H |
N N N |
O=O |
F—F |
H—Cl |
| 键能 |
436 |
946 |
498 |
157 |
431 |
| 键 |
N—N |
P—P |
P—O |
Cl—Cl |
Br—Br |
| 键能 |
193 |
198 |
360 |
242.7 |
193 |
①由表中所列化学键形成的单质分子中,最不稳定的是。
②通过表中键能数据,计算说明N2分子中的键比键稳定(填“ ”或“
”或“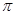 ”)。
”)。
③化学反应的实质是旧化学键断裂和新化学键形成的过程。现有化学反应方程式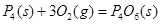 ,通过计算可以确定,1molP4(s)参加该反应,(填“吸收”或“放出”)的热量为kJ。
,通过计算可以确定,1molP4(s)参加该反应,(填“吸收”或“放出”)的热量为kJ。