芳香醛与活性亚甲基化合物的缩合反应在有机合成中有重要应用,化合物III是医药中间体,其合成方法如下:
反应①: 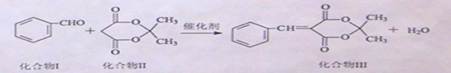
化合物Ⅱ也可以由化合物IV(C3H6Cl2)经以下途经合成: 
(1)化合物II的分子式为 ,1mol化合物III最多与 mol H2发生加成反应。
(2)化合物IV转化为化合物V的反应类型是 ,化合物V和化合物VII能形成一种高分子聚合物,写出该聚酯的结构简式 。
(3)由化合物VI转变成化合物VII分两步进行,其中第一步是由化合物VI与足量的银氨溶液共热反应,写出其化学反应方程式 。
(4)E是化合物II的同分异构体,且E是一种链状结构,在核磁共振氢谱中有3种氢, 1mol E能与2 molNaHCO3反应,写出化合物E的结构简式 。(任写一种;不考虑顺反异构。)
(5)化合物I与化合物 (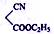 )在催化剂条件下也能发生类似反应①的反应得到另一医药中间体,写出该反应化学方程式 。
)在催化剂条件下也能发生类似反应①的反应得到另一医药中间体,写出该反应化学方程式 。
类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3、,但当铁过量时,产物是 Fe ( NO3 ) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
( 1 )提出假设: A 是 FeCl3, B 是 FeCl 2。
( 2 )设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
( 3 )根据上述实验结论,写出 C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________。
( 4 )为进一步探究 FeC13溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____________________。
A.将 A 溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加 Na OH 浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到 FeC13固体
( 5 )实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加人过量的铁粉,充分反应后,过滤。在所得滤渣中加人足量的盐酸,充分反后,再过滤即得到铜。方案1 中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加人适量的盐酸调节溶液的 pH =" 1" ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。方案 2 中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)___________________________________________________
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为 45.3g 的该结晶水合物,分别制成溶液。向其中一份逐滴加人 NaOH 溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到 2.24L 该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加人 Ba (OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体 46.6g 。
请回答以下问题:
( l )该结晶水合物中含有的两种阳离子是______和_________,阴离子是___________。
( 2 )试通过计算确定该结晶水合物的化学式。
( 3 )假设过程中向该溶液中加人的 NaOH 溶液的物质的量浓度为5mol·L一1,请在右图中画出生成沉淀的物质的量与加入 NaOH 溶液体积的关系示意图。
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合酸加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃下发生反应。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水氯化钙于燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
(1)配制一定比例浓硝酸和浓硫酸混合酸时,操作注意事项是;
(2)步骤③的加热方式是;
(3)步骤④中,洗涤、分离粗硝基苯应使用的仪器是;
(4)步骤④中,粗产品用5%的NaOH溶液洗涤的目的是;
(5)现有三种实验装置,如下图所示,要制备硝基苯,应选用()
(1)“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如右图所示: “立方烷”的分子式是_________________;该立方烷的二氯代物具有同分异构体的数目是___________________。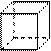
(2)写出分子式为C4H10O属于醇类的可能结构简式并命名:_________________
。
苯环上原有取代基对苯环上再导入另外取代基的位置有一定影响。其规律是:
(1)苯环上新导入的取代基的位置主要决定于原有取代基的性质;
(2)可以把原有取代基分为两类:
①原取代基使新导入的取代基进入苯环的邻、对位;如:-OH、-CH3(或烃基)、-Cl、-Br等;②原取代基使新导入的取代基进入苯环的间位,如:-NO2、-SO3H、-CHO等。
现有下列变化:(反应过程中每步只能引进一个新的取代基)
 |
(1)请写出其中一些主要有机物的结构简式:
A B C D E
(2)写出①②两步反应方程式:① ,
② 。