氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。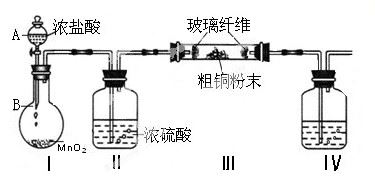
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
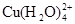 (aq) +4Cl-(aq)
(aq) +4Cl-(aq)
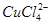 (aq) +4H2O(l)
(aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是 。
化合物A(C11H8O4)在NaOH溶液中加热反应后再酸化可得到化合物B和C。回答下列问题:
(1)B的分子式为C2H4O2,分子中只有一个官能团,且能与乙醇发生酯化反应,请写出两种能发生银镜反应的B的同分异构体的结构简式_______、_______
(2)C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是________。
(3)已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是___________。
(4)A的结构简式是___________
X、Y、Z、L、M五种元素的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量较高的金属元素,回答下列问题
(1)五种元素的原子半径从大到小的顺序为(用元素符号表示)
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,其中 A的电子式为。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的最高价氧化物对应的水化物的化学式为。该族2-5周期元素单质分别与H2反应生成1mol气态氧化物的反应热如下,表示生成1mol硒化氢的反应热是(填字母)。
a.+99.7mol/L b.+29.7mol/L c.-20.6mol/Ld.-241.8KJ/mol
(4)Z的最简单气态氢化物甲的水溶液成碱性,在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生的产物不污染环境,其化学方程式为。
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,A元素原子的核外电子数与其所在周期数相等,B元素原子核外有3个能级上有电子,且每个能级上的电子数相同;D元素原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4其分别结构式为_________、_________。
下列反应中,属于放热反应的是,属于吸热反应的是(填序号)。
①煅烧石灰石(主要成分CACO3)制取生石灰(CAO) ②燃烧木炭取暖 ③炸药爆炸④酸与碱中和反应 ⑤食物因氧化而腐败 ⑥生石灰与水作用制熟石灰⑦BA(OH)2·8H2O晶体与NH4Cl晶体⑧金属钠与水的反应
下表是元素周期表的一部分,回答下列有关问题: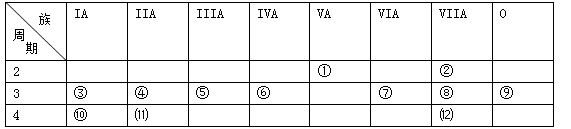
(1)写出下列元素符号:①,⑥,⑦。
(2)在①-⑿元素中,金属性最强的元素是,非金属性最强的元素是,最不活泼的元素是。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
| A.常温下⑦的单质和⑧的单质状态不同 |
| B.⑧的氢化物比⑦的氢化物稳定 |
| C.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应 |
| D.⑧的最高价氧化物的水化物的酸性比⑦的最高价氧化物的水化物的酸性强 |