现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,A元素原子的核外电子数与其所在周期数相等,B元素原子核外有3个能级上有电子,且每个能级上的电子数相同;D元素原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4其分别结构式为_________、_________。
(共12分)
醛类是重要的有机物。
47.松柏醇臭氧化反应生成的B含有醛基。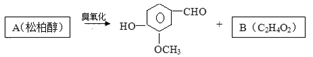
写出结构简式:B;A。
48.已知: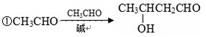
②醛甲+醛乙 醇+羧酸(歧化反应,简单的醛被氧化)
醇+羧酸(歧化反应,简单的醛被氧化)
醛基旁边的碳原子上的H原子叫α-H原子,比较活泼。制备季戊四醇的反应“流程”如下: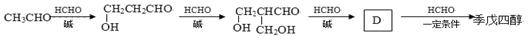
(1)写结构简式:D;季戊四醇。
(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂, 试简述其可做洗涤剂的结构原因。
(3)实际生产中甲醛过量,原因是。
49.酯交换反应是指:酯+醇(酚)→新酯+新醇(酚)。松柏醇的一种芳香族同分异构体有以下特点:
①有邻位的2个取代基;②遇氯化铁溶液呈紫色;③发生分子内的酯交换反应,生成有六元环的内酯和甲醇,则该内酯的结构简式为。
50.环己酮中α-H也比较活泼,能发生以下反应: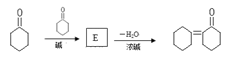 则E的结构简式为。
则E的结构简式为。
(本题共10分)
煤焦油中含有多种芳香族化合物,是重要的化工原料。以下是用煤焦油制备均三溴苯的流程。
42.操作①的名称是;试剂①是;反应②中,NaHS作剂。
43.均三溴苯的系统命名为。
44.不用硝基苯直接溴化制取均三溴苯,理由是。指出苯胺比苯更易发生取代反应的二个事实。
45.苯胺是微溶于水的液体,呈弱碱性。若苯胺中含少量的苯和硝基苯,简述提纯步骤。
46.氨基与羟基有许多相似的性质,则苯胺与醋酸酐[(CH3CO)2O]在一定条件下反应,除了生成CH3COOH外,
生成的另一种有机物的结构简式为。
(本题共12分)
氨气是重要的化工原料。
38.实验室可用浓氨水和_____(选填编号)来制取氨气。
a.烧碱b.生石灰 c.氯化铵
检验氨气易溶于水的简单操作是:收集一试管氨气,。
39.往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入。
侯德榜制碱法(联合氨碱法)的CO2来自_____(选填编号)。
a.石灰石煅烧
b.含碳物质燃烧
c.合成氨厂的副产品
40.往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深(绛)蓝色,有[Cu(NH3)4]2+生成。往溶液中滴加稀硫酸,溶液变为淡蓝色。颜色变浅的主要原因可能是:
①溶液变稀;②[Cu(NH3)4]2++4H+ Cu2+ + 4NH4+
Cu2+ + 4NH4+
请设计一个简单实验说明溶液变浅的主要原因。
41.某实验小组设计了下列装置进行氨的催化氧化实验。
(1)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因可用化学方程式表示为:、。
(2)实验前,烧杯中盛有200mL 1.000 mol/L NaOH溶液,实验后将烧杯中溶液蒸干,再将所得固体加热至恒重,得到固体10.9g,则该固体含NaOHg。
(本题共12分)磷是重要的非金属元素。
28.有关白磷(P4)的叙述正确的是(选填编号)。
a.易溶于CS2b.易自燃c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式。
由该反应可推知H3PO2为元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是。
29.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是(选填编号)。
a.升高b.降低c.既升高又降低
30.25℃时,HF的Ki =" 3.6×10" – 4 ;
H3PO4的Ki1=" 7.5×10" -3,Ki2=" 6.2×10" -8,Ki3=" 2.2×10" -13。
则以下表述错误的是(选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因。
(本题共12分)氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是(选填编号)。
A.电子层B.电子亚层
C.电子云的伸展方向D.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是(选填编号)。
A.H为-1价B.熔融状态能导电C.加热到600℃不分解
LiH的电子式为。核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式。在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义。
| 共价键 |
键能(KJ/ mol) |
| N≡N |
946 |
| H-H |
436 |
| H-N |
391 |
27.钯(Pd)是优良的储氢金属:2Pd(s)+xH2(g) 2PdHx (s)∆H=-Q(Q>0)
2PdHx (s)∆H=-Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是;为使PdHx产生H原子并在固体中快速流动,可采取的措施是(选填编号)。
A.升温B.减压C.及时移走金属钯