(本题共12分)氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
A.电子层 B.电子亚层
C.电子云的伸展方向 D.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
A.H为-1价 B.熔融状态能导电 C.加热到600℃不分解
LiH的电子式为 。核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
| 共价键 |
键能(KJ/ mol) |
| N≡N |
946 |
| H-H |
436 |
| H-N |
391 |
27.钯(Pd)是优良的储氢金属:2Pd(s)+xH2(g) 2PdHx (s)∆H=-Q(Q>0)
2PdHx (s)∆H=-Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
A.升温 B.减压 C.及时移走金属钯
工业上从海水制取溴时,是以氯气氧化海水中的Br-,然后用空气将溴吹出,以碳酸钠溶液吸收。再用硫酸酸化得到单质溴。
(1)写出各步反应的化学方程式。
(2)把滤纸用淀粉和碘化钾的溶液浸泡,晾干后即得淀粉碘化钾试纸。将试纸润湿后,放在盛有溴气的集气瓶口,观察到的现象是,原因是(用化学方程式和必要的文字说明)。
现有0.1mol/L的AlCl3溶液和0.1mol/L的氢氧化钠溶液,进行下面的实验。
(1)在试管中取AlCl3溶液10mL,向其中逐滴加入NaOH溶液,请画出产生白色沉淀物质的量随NaOH溶液加入量变化的趋势图。
(2)向盛有10mLNaOH溶液的试管中滴入AlCl3溶液,边滴加边震荡,产生的现象是_ _;当加入 毫升AlCl3溶液时开始出现沉淀;当加入毫升AlCl3溶液时,产生的沉淀量最多。写出上述过程中所涉及到的的相关离子方程式_ .。
保护环境、保护地球已成为人类共同的呼声。
(1)引起温室效应的主要物质是;
(2)以煤炭为主的能源结构易导致酸雨的形成,形成这类酸雨的气体是,形成过程发生的化学反应有:、、
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系。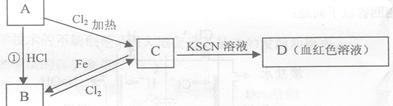
试回答下列问题:
(1)A是_____________。
(2)C是__________。
(3)C的溶液与NaOH溶液混合后产生的现象是___________________________。
(4)反应①的反应类型是___________________。
以下是氮循环的一部分: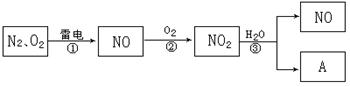
(1)通常状况下,NO2的颜色是;
(2)反应①的化学方程式是;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是 ;
(4)化合物A的化学式是;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为mol。