现有0.1mol/L的AlCl3溶液和0.1mol/L的氢氧化钠溶液,进行下面的实验。
(1)在试管中取AlCl3溶液10mL,向其中逐滴加入NaOH溶液,请画出产生白色沉淀物质的量随NaOH溶液加入量变化的趋势图。
(2)向盛有10mLNaOH溶液的试管中滴入AlCl3溶液,边滴加边震荡,产生的现象是_ _;当加入 毫升AlCl3溶液时开始出现沉淀;当加入 毫升AlCl3溶液时,产生的沉淀量最多。写出上述过程中所涉及到的的相关离子方程式_ .。
德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:
①按下图所示的装置图连接好各仪器;②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;
④待烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。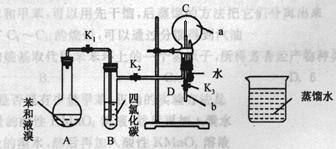
试回答:
(1)A中所发生的反应的反应类型为,能证明凯库勒观点错误的实验现象是;
(2)装置B的作用是 ;
(3) 写出A中发生反应的化学方程式;
(4)实验前应对A、B、C三个装置的气密性进行检查,则检查装置C的气密性的操作为
。
在某化学反应中,反应混合物A、B、C的物质的量浓度(mol·L—1)与时间t(s)关系如表所示。
| t(s) |
200 |
400 |
800 |
| c(A)(mol·L—1) |
1.45 |
1.28 |
1.00 |
| c(B)(mol·L—1) |
0.38 |
0.72 |
1.28 |
| c(C)(mol·L—1) |
0.095 |
0.18 |
0.32 |
(1)该反应的化学方程式为。
(2)用A浓度变化表示200~800 s内反应的平均反应速率为mol/(L·min)。
(3)用C浓度变化表示400~800 s内反应的平均反应速率为 mol/(L·s)。
已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,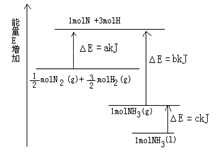
(1)1mol N 和3mol H 生成1mol NH3(g)是能量的过程(填“吸收”或“释放”)。
(2)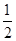 N2(g)+
N2(g)+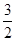 H2(g)
H2(g)  NH3(g )△H=;
NH3(g )△H=;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________
________________________________________________________________________。
(2)要加快上述实验中气体产生的速率,还可采取的措施有______________________
__________________________________________________________________(答两种)。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
其中:V1=,V6 ,V9=。
在密闭容器里,通入x mol H2和y mol I2 (g),改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1) 升高温度;
(2) 加入催化剂;
(3) 充入更多的H2;
(4) 扩大容器的体积;
(5) 容器容积不变,通入氖气。