(10分)短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是
(填元素符号或化学式,下同);第一电离能从大到小的顺序是
(2)由A、C两种元素形成的离子化合物中C元素的质量分数为73.68%,它的所有原子最外层都符合相应的稀有气体原子的最外层电子层结构,该物质加热时就能分解为两种气体,则X的化学式为 ,X受热分解的化学方程式为_____________________ 。
(3)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,与Y的阴离子具有相同原子数和电子数的分子有 (任写一种),Y与盐酸反应的离子方程式为 。
(4)(CA4)2SO4溶液加水稀释时,溶液中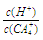 的值将 (填“增大”、“减少”或“不变”)。
的值将 (填“增大”、“减少”或“不变”)。
化合物A、B、C、D、E分别由H+、Na+、Al3+、Cu2+四种阳离子和CO32-、Br-、SiO32-、SO42-四种阴离子组成。已知①A、B、C三种溶液pH<7,D、E溶液pH>7②A、C的阴离子相同,D、E的阳离子相同③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通入E的溶液中可产生另一种白色沉淀。
请根据以上事实填空:
⑴写出B、C、E的化学式:B___________、C___________、E____________。
⑵D溶液的pH>7,原因是:(结合离子方程式说明)__________________________________。
⑶写出C溶液与D溶液发生反应的离子方程式:_______________________。
⑷若用石墨电极电解400mL 1.0 mo1·L—1 A的溶液,当阳极有2.24 L气体(标准状况)产生时,溶液的pH=_______________(设溶液的体积不变)。
(8分)在一定条件下可实现下图所示物质之间的变化: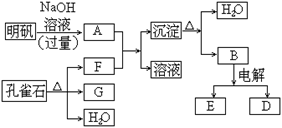
请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解。上图中的F的电子式为。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式。
(4)D与NaOH溶液反应的化学方程式为(用单线桥标出电子转移的方向及数目)。
(9分)芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示: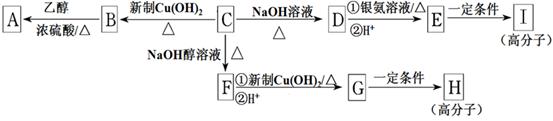
(1)F中含氧官能团的名称是;B→A的反应类型是。
(2)C的结构简式是,H的结构简式是。
(3)写出下列化学方程式:
① D与银氨溶液反应___________;② E→I。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由_______________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中核磁共振氢谱有4个峰的结构简式____________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g )△H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g )△H=—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为。
②100℃时反应I的平衡常数为。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是(填字母序号)。
| A.c ( H2 )减少 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 | D.重新平衡c ( H2 )/ c (CH3OH )减小 |
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程: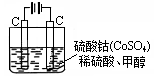
①写出阳极电极反应式。
②写出除去甲醇的离子方程式。
③若右图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式:,净化含1 mol甲醇的水燃料电池需消耗KOH
mol。
(9分)已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为;N的电子式为
(2)试比较M和N的稳定性:M(填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式:;
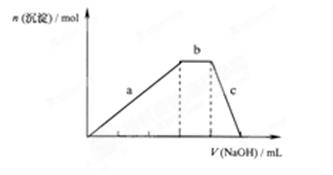
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1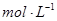 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写b出阶段的离子方程式:
②根据图像判断该盐的化学式为。