(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中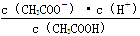 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
某人设计淀粉利用方案如图所示:其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)C6H12O6的名称是_____,A的电子式为_______,C中含有官能团名称;
(2)A→B反应类型_____________;C→D反应类型_________________
(3)写出下列转化的化学方程式:
①A→B:,
②C→D:,
③CH3CH2OH→CH3CHO:。
下表是元素周期表的一部分,请回答有关问题: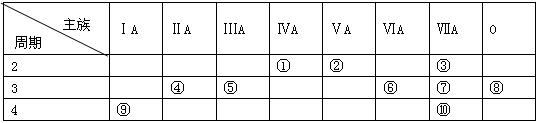
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ;
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式为;
(3)②、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是(填化学式);
(4)⑨与④两种元素的最高价氧化物的水化物碱性较强的是(填化学式);
(5)①的单质与②最高价氧化物的水化物浓溶液反应的化学方程式是;当消耗4.8g①的单质时,转移电子数为。
Ⅰ.①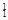 H与
H与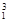 H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷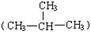 ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______ (填序号,下同)。
(2)互为同系物的是______。
(3)互为同分异构体的是______。
(4)互为同素异形体的是______。
II.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题。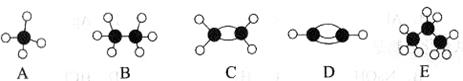
(1)D的电子式为___________,A的二氯取代物有种。
(2)可作为植物生长调节剂的是(填结构简式);
(3)A与氯气反应可以生成多种物质,试任写其中一个反应的化学方程式:;
(4)C与水在一定条件下反应的化学方程式为:。
Ⅰ.在一定条件下,xA+yB  zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向______移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为______。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。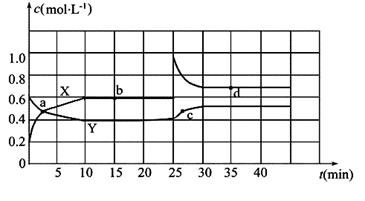
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,
表示化学反应处于平衡状态的点是__________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______。
N2O4(g)的平衡常数Kb=_______。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.缩小容器体积
C.升高温度D.加入一定量的N2O4
近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: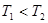 )
)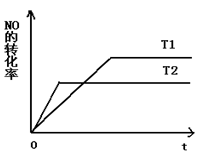
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热)反应。
N2(g)+O2(g)为(填“吸热”或“放热)反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g)已达到平衡的是(填序号)。
N2(g)+O2(g)已达到平衡的是(填序号)。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2=.
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为。