下列反应的离子方程式正确的是 ( )
| A.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应: CH3OH+6OH--6e-=CO2↑+5H2O |
| B.在NaHSO4溶液中加Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C.过量氨水与AlCl3溶液反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.向饱和NaCl溶液中通入足量氨气和CO2后有晶体析出: |
Na++NH3+CO2+H2O=NaHCO3↓+NH4+
对可逆反应4NH3(g) + 5O2(g)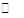 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是2v正(NH3)=3v正(H2O) |
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是
2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是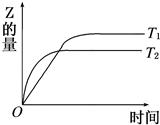
| A.T1<T2,正反应是放热反应 | B.T1<T2,正反应是吸热反应 |
| C.T1>T2,正反应是放热反应 | D.T1>T2,正反应是吸热反应 |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(l),△H=-483.6 kJ·mol–1,则2molH2(g)和1molO2(g)所含有的总能量比2mol H2O(l)所含有的总能量少483.6kJ |
| B.己知2C(s)+2O2(g)=2CO2(g)△H12C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| C.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| D.利用盖斯定律可以间接计算通过实验难以测定反应的反应热 |
下列关于金属的腐蚀与防护的说法中正确的是
| A.舱底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| B.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀。 |
| C.铁表面镀银,铁作阳极 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
| A.x=2 |
| B.2 min内A的反应速率为0.6 mol·L-1·min-1 |
| C.B的转化率为40% |
| D.若混合气体的密度不变,则表明该反应达到平衡状态 |