(12分)下图类似奥运五元环,表示A、B、C、D、E五种化合物,元环交叉部分代表两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料; C能发生反应:化合物(Ⅰ)+化合物(Ⅱ)  化合物(Ⅲ)+化合物(Ⅳ);D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2.
化合物(Ⅲ)+化合物(Ⅳ);D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2.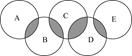
(1) D的化学式为________.
(2)A、B、E中含有一种相同的元素,其在周期表中的位置________.
(3)B和E反应可生成单质G和常见的液态化合物H,写出化学方程式__________________.
(4)写出C符合“化合物(Ⅰ)+化合物(Ⅱ)  化合物(Ⅲ)+化合物(Ⅳ)”的化学方程式________________________________.
化合物(Ⅲ)+化合物(Ⅳ)”的化学方程式________________________________.
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: 请回答:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱 酸。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
| A.前者大 | B.后者大 | C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,HA是酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH—)=mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。c(Na+)-c(A—)=mol/L
(5分)日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为: ① 。
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg[c(H+)/c(OH-)]。
(2)中性溶液的AG= ② 。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG=③ ,由水电离的c(H+)=④ 。
在固定容积的密闭容器中,有可逆反应nA(g)+mB(g)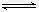 pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值①,混合气体的密度②;降温时,混合气体的平均相对分子质量 ③;加入催化剂,气体的总物质的量④;充入C,则A、B的物质的量⑤。(增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值①,混合气体的密度②;降温时,混合气体的平均相对分子质量 ③;加入催化剂,气体的总物质的量④;充入C,则A、B的物质的量⑤。(增大、减小、不变、不确定)
可逆反应3A(g) 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①;
b.若B、C都不是气体,气体的平均相对分子质量② ;
c.若B是气体,C不是气体,气体的平均相对分子质量③ ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④态,C是⑤态。
化学电池分为① ,②,③,其中碱性锌锰电池属于④,铅蓄电池属于⑤。