NaHCO3在水溶液中,HCO3-的电离程度小于HCO3-的水解程度。回答下列有关问题:
⑴H2CO3的电离方程式为 ;
⑵NaHCO3溶液显碱性,原因是(用离子方程式表示)
;
⑶在该溶液中,c(Na+)、c(H+)、c(HCO3-)、c(OH-)的大小关系为
;
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)= ;
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)= 。
某固体氯化铁中混有氯化亚铁,为测定其中铁的质量分数,现进行如下实验: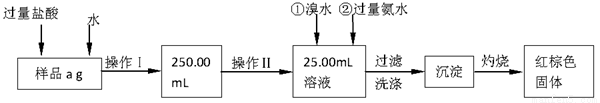
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有。(填仪器名称)
(2)进行操作Ⅱ所选用的仪器是。
| A.50ml量筒 | B.25ml量筒 | C.50ml碱式滴定管 | D.50ml酸式滴定管 |
(3)写出向该溶液中加入氯水和过量氨水时发生的离子方程式分别是,
(4)在过滤洗涤时,用什么方法证明沉淀已洗涤干净
(5)称量灼烧后所得固体为b1g,再灼烧再称量为b2g,若b1-b2=0.3g,某同学认为已符合要求,你认为是否符合要求,理由是什么。
(6)若样品质量为ag,最后所得固体质量为bg,写出铁的质量分数表达式(不用化简)。
(7)有人认为该实验中有一步操作是不必要的,请指出该步操作是。
(8)若证明操作Ⅰ所得溶液中含有Fe3+,写出所需试剂的名称。
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。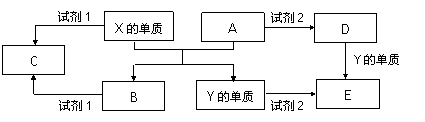
(1)写出D-----E的离子方程式___________________________________________________________
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是
_________________________________________________________________________________________
(3)若试剂1和试剂2均是稀硫酸。
检验物质D的溶液中金属离子的方法是_____________________________________________________
C溶液与碳酸氢钠溶液混合时的反应现象_________________________________________
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:试回答下列问题: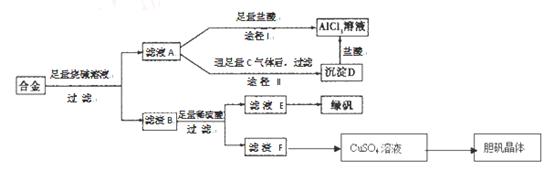
(1)器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是(填名称)。
(2)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是____________。
写出A经途径Ⅱ生成D的离子方程式。
(3)从滤液E中硫酸得到绿矾晶体的实验操作是。
(4)写出用滤渣F制备CuSO4溶液的化学方程式(要求节约,环保)
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理,理由是
A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
(1)写出A、B、C、D、E、F的化学式:
B.________;C.________;D.________;E.________;
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
E→B: _______________________________________________,
C→F: ____________________________________________________,
F→C: ____________________________________________________。
(3)下列实验方案中,不能准确测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A. 取a克混合物充分加热,减重b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体直接用碱石灰吸收,增重b克
D. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
某澄清溶液,可能含有NH4+、Mg2+、Al3+、Na+、Cu2+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
①在试管中取少许溶液,滴加几滴石蕊试液,溶液呈红色。
②另取原溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫红色。
③向②所得水溶液中加入AgNO3溶液,有白色沉淀生成。
④另取原溶液,滴加NaOH溶液,得白色沉淀;继续加入NaOH溶液至过量,沉淀部分溶解,过滤后给滤液加热,有刺激性气味的气体产生。
(1)由此判断原溶液中一定有大量的离子。
(2)步骤②反应的离子方程式是________________________________
(3)步骤④中沉淀溶解的离子方程式是
(4)还不能确定的阳离子是,如何检验?(写出实验名称及判断依据的现象)
____________________________________________________________________.