硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在;硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I- 。
(Ⅰ)制备Na2S2O3·5H2O
打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热。圆底烧瓶中发生反应的化学方程式是 。
C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。C中碳酸钠的作用
是 。“停止C中的反应”的操作是 。
过滤C中的混合液。将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。“过滤”用到的玻璃仪器是(填仪器名称) 。
装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.95 |
17.10 |
20.05 |
滴定时,达到滴定终点的现象是 。
Na2S2O3·5H2O在产品中的质量分数是 (用百分数表示,且保留1位小数)。
向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度为mol∙L-1;
(2)在标准状况下产生气体的体积为L。
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验: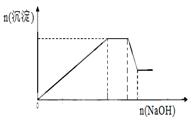
第一步:加入过量的稀盐酸,无沉淀生成。
第二步:继续加入过量的稀硫酸,有白色沉淀生成。
第三步:过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,
在此过程中溶液沉淀量的变化如右图所示,加热该溶液,
可产生使湿润的红色石蕊试纸变蓝色的气体。
根据以上实验现象回答下列问题:
(1)该待测液中一定含有离子,一定没有离子,可能有离子。
(2)某同学采用测pH的方法来判断滴入NaOH溶液后是否使溶液呈碱性,该实验操作是。
(3)第三步中产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为,该步骤中预
期会出现另外一个特殊的实验现象,该现象对应的化学方程式为。
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如下图所示:
请回答下列问题:
(1)若A为金属单质,B为非金属氧化物,则该反应的化学方程式为;请写出质量数为26的A的一种核素符号。
(2)若A为金属单质,B为黑色磁性晶体,则该反应的化学方程式为;请写出A与氢氧化钠溶液反应的离子方程式;
(4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是NA。
常温下,将0.05 mol·L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA。
(1)此一元弱酸的物质的量浓度为;
(2)此条件下该一元弱酸的电离平衡常数为。