已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是
将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是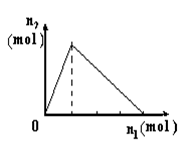
| A |
B |
C |
D |
|
| X |
NaOH |
AlCl3 |
HCl |
NaAlO2 |
| Y |
AlCl3 |
NaOH |
NaAlO2 |
HCl |
在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后
| A.天平保持平衡 | B.左高右低 | C.左低右高 | D.无法确定 |
物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的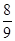 (同温同压下),此时N2、O2、CO2的物质的量之比为
(同温同压下),此时N2、O2、CO2的物质的量之比为
| A.1∶1∶0 | B.6∶9∶0 | C.3∶4∶1 | D.3∶3∶2 |
某溶液中含有HCO3-、Na+、Ba2+、NO3-4种离子,若向其中加入少量Na2O2固体后溶液中离子浓度基本保持不变的是
| A.HCO3- | B.Na+ | C.Ba2+ | D.NO3- |
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.1.5 mol·L-1 | B.2.0 mol·L-1 | C.0.18 mol·L-1 | D.0.24 mol·L-1 |