下列解释过程或事实的方程式不正确的是
A.熔融烧碱时,不能使用普通石英坩埚: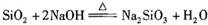 |
B.在海带灰的浸出液(含有r)中滴加H2O2得到I2: |
C.红热的铁丝与水接触,表面形诸蓝黑色(或黑色)保护层: |
| D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分HCl)混合使用放出氯气: |
某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g)  CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是()
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是()
| A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1 |
| B.达平衡时压强变为原来的7/6 |
| C.此温度下该反应的平衡常数为0.012 5 |
| D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7% |
密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是()
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是()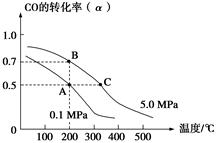
A.若A、B两点表示在某时刻达到的平衡状态,此时A、B两点时容器中,n(A)总∶n(B)总=4∶5
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA<tC
C.设B、C两点的平衡常数分别为KB、KC,则KB<KC
D.在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热:23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是()
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①的体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
1.0 L |
| 温度/℃ |
T1 |
T2 |
T3 |
| 反应物起始量 |
1.5 mol A 0.5 mol B |
1.5 mol A 0.5 mol B |
6.0 mol A 2.0 mol B |

下列说法正确的是()
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
在恒容密闭器中通入物质的量浓度均0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是()
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是()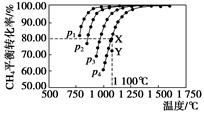
| A.上述反应的ΔH>0 |
| B.压强p1>p2>p3>p4 |
| C.1 100 ℃该反应的平衡常数为64 |
| D.压强为p4时,在Y点:v(正)<v(逆) |