电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下: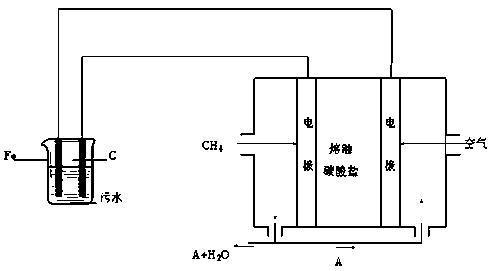
⑴实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
⑵电解池阳极的电极反应分别是① ;
②4OH- - 4 e-= 2H2O +O2↑。
⑶电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
⑷该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
⑸实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)___________L。
在下列事实中,什么因素影响了化学反应速率?
①天的食品易霉变,冬天就不易发生该现象。
②熔化的氯酸钾放出气泡较慢,撒入少量二氧化锰很快产生气体。
③工业上常将固体燃料粉碎,以提高燃烧效率。
④同体积、同浓度的盐酸与同样大小的锌条和镁条反应,产生气体前慢后快。
⑤同体积、同浓度的硫酸和盐酸与同样大小质量相等的锌粒反应,产生气体前者快。
在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效的催化剂
在一体积为10 L的容器中,通过一定量的CO和H2O,850 ℃时发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=______mol·L-1·min-1。
(2)如图中4~5min之间该反应________(填“是”或“否”)处于平衡状态,判断理由________________________________________________________________________。
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W的最外层电子数相等,X、Z为同一主族,Y、Z两种元素的质子数之和为W、X两种元素质子之和的3倍。由此可知元素W为,X为 ,Y为,Z。上述元素中任意三种元素组成的既含有离子键又含有共价键的化合物化学式为(至少写三种)。能形成共价化合物的化学式有、、、。
有H、C、O、Cl、Na五种元素。
(1)在由两种元素组成的化合物里,其中离子化合物有(写2种)______________________,共价化合物有(写2种)______________________。
(2)在由三种元素组成的化合物里,其中离子化合物有(写2种)______________________,共价化合物有(写2种)______________________。