已知在0.1 mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为:
c(Na+)>c(HSO)>c(SO)>c(H2SO3)。
(1)则该溶液中c(H+)________c(OH-)(填“<”、“>”或“=”),简述理由(用离子方程式和必要的文字说明)________________ ____________________________________
____________ ________。
(2)现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是________________________________________________________________________;
写出该反应的离子方程式_____________ _________________________
(10分)现有下列几种物质:①铝②石墨③氢氧化钠④BaSO4晶体⑤H2SO4⑥CO2⑦食盐水⑧乙醇⑨熔化的KNO3 ⑩泥浆水⑾淀粉溶液⑿氧化钙,
请用编号填写下列空格:
(1) 属于电解质的是(填代号,以下同),属于非电解质的是,能导电的是。
(2)属于分散系的有 ,其中属于胶体的有 。
某些化学反应可用下式表示:A + B= C + D + H2O
请回答下列问题:
(1)若A、D均可用于消毒,且C是家家户户的厨房必备的调味品之一,写出该反应的离子方程式:。
(2)若A为水垢的主要成分之一,B是厨房日常生活常见有机物,写出该反应的化学方程式:。
(3)若A为亮红色单质,B为第二周期某种元素的最高价氧化物的水化物,A、B、C、D中只有D是气体,若D无色且在空气中容易变为红棕色气体,写出该反应的化学方程式:。
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族。请回答下列问题。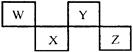
(1)请写出各对应的元素符号:W、 X、 Y、 Z。
(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的化学式为
(3)电解NaZ水溶液时,总反应化学方程式为。工业上,以上述反应的阳极产物和Ca(OH)2为原料,制备漂白粉反应的化学方程式为。
(4)已知:元素钠与元素Y可组成原子个数比为1:1的化合物。请写出该化合物与含W的最高价氧化物发生反应的化学方程式为。
、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)、配平下列化学方程式(并解答对应问题):
KMnO4+HCl==KCl+MnCl2+Cl2↑+H2O
氧化剂还原剂
(1) 甲烷的分子个数为1.204×1023,则甲烷的物质的量为______ mol,所含的原子个数共有______个,与这些甲烷质量相等的O2的物质的量为 ______________ mol。
(2)含有相同氧原子数目的NO和NO2两种气体,其质量比,物质的量比为,在标准状态下,体积比为。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为________。
②所得溶液中Cl-的物质的量为________mol。
③所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。