、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)、配平下列化学方程式(并解答对应问题):
KMnO4+ HCl== KCl+ MnCl2+ Cl2↑+ H2O
氧化剂 还原剂
(16分)I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题: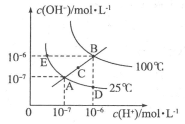
(1)图中A、B、C、D四点的 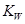 由大到小的顺序:______。
由大到小的顺序:______。
(2)若从A点到D点,可采用的方法是________________________。
(3)在100℃时,将pH=2的硫酸与pH=12的KOH溶液混合至呈中性,需硫酸和氢氧化钾的体积比为____。
Ⅱ.(1)室温下,向氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH_______7(填“>”、“<”或“=”),用离子方程式表示其原因________________________,所得溶液中各离子物质的量浓度由大到小的顺序为____________;
(2)氨水中加入少量氯化铵固体,NH3.H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中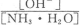 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为: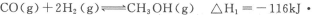
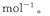
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是_____。
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.增大体系压强
d.使用高效催化剂
(2)已知: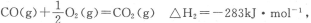
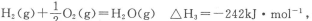
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________________.
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答: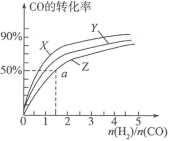
①在图中三条曲线,对应的温度由高到低的顺序是__________________;
②利用a点对应的数据,计算出曲线Z在对应温度下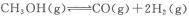 的平衡常数:K=______;
的平衡常数:K=______;
(4)恒温下,分别将1 molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应。
①达到平衡所需时间是I _____Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中CH3OH的体积分数关系是I_____Ⅱ。
②平衡时,测得容器工中的压强减小了30%,则该容器中CO的转化率为______。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A + B→白色沉淀,加入稀硝酸,沉淀不溶解
②B + D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
(1)试推断ABCD(化学式)。
(2)写出下列反应的化学方程式或离子方程式:
①实验②中沉淀由白色转化为红褐色的化学方程式,
②C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中的离子方程式。
(1)质子核磁共振谱是研究有机化合物结构的有力手段之一。结构中的等效氢原子在核磁共振谱中都给出了相应的峰值(信号),谱中峰的强度与结构中的H原子数成正比。试回答:
有机化合物 ,在核磁共振氢谱中观察到峰值给出的强度之比为_______________。
,在核磁共振氢谱中观察到峰值给出的强度之比为_______________。
(2)烷基取代苯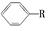 可以被KMnO4酸性溶液氧化生成
可以被KMnO4酸性溶液氧化生成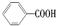 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化生成
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化生成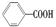 ,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成
,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成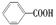 的异构体共有7种,其中的2种是
的异构体共有7种,其中的2种是 、
、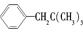
请写出其他5种的结构简式:____________________________________________________。
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a1×10-14(填“>”、“<”或“=”),做此判断的理是。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=。
(3)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=;此溶液中各种离子的浓度由小到大的顺序是。