铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe 2O3(s)+3CO(g)
2O3(s)+3CO(g)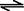 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁ll.2g。则10min内CO的平均反应速率为 。
L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁ll.2g。则10min内CO的平均反应速率为 。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
① ②
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(V)和温度(T)的关系示意图中与铝热反应最接近的是 。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:
欲使上述体系中Al3+浓度增加,可加入的物质是 。
碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入(填“酸式滴定管”或“碱式滴定管”),原因是。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是。
(3)滴定时向待测液中加入的指示剂是,到达滴定终点时的现象为。
(4)用c 、V1和V2表示c(I3—)为mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—)(填“偏大”、“偏小”或“不变”) 。
常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HCl的物质的量浓度 (mol·L-1) |
BOH的物质的量浓度 (mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.2 |
pH>7 |
请回答:
(1)从第①组情况分析,BOH是(选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的c(OH—)=mol·L-1。
(2)第②组情况表明,c0.2。该混合液中离子浓度c(B+)c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中(选填“<”、“>”或“=”)
甲:BOH的电离程度BCl的水解程度
乙:c(B+)—2 c (OH—)c(BOH)—2 c(H+)
图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题: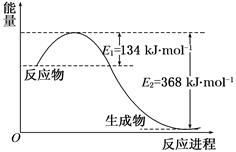

a b
(1)写出NO2和CO反应的热化学方程式。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=。
(3)此温度下该反应的平衡常数K=;温度降低,K(填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1 mol NO2 1 mol CO |
2 mol NO 2 mol CO2 |
1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 |
1.5 |
3 |
m |
| 能量变化 |
放出a kJ |
吸收b kJ |
放出c kJ |
| CO或NO的转化率 |
α1 |
α2 |
α3 |
则:α1+α2=, a+b/2=,m=
现有3.58gNa2CO3和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加80.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为896ml(设气体全部逸出,下同)。回答下列问题:
(1)其中过量。
(2)固体混合物中Na2CO3和NaHCO3的物质的量之比为。
(3)取xg上述Na2CO3和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加40.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为448ml,则x的值可能为。
(4)取xg上述Na2CO3和NaHCO3的固体混合物,将其制成溶液后,边搅拌边逐滴滴加40.0ml 1.0mol/L 盐酸,反应完全后生成的CO2气体折算成标准状况下的体积为yml,当2.864≤x<14.32时,y与x的函数关系式是y=。
氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4—的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。