将有机物完全燃 烧,生成CO2和H2O。将12 g该有机物的完全燃烧产物通过浓H2SO4,浓H2SO4增重14.4 g,再通过碱石灰,又增重26.4 g。该有机物分子式为
烧,生成CO2和H2O。将12 g该有机物的完全燃烧产物通过浓H2SO4,浓H2SO4增重14.4 g,再通过碱石灰,又增重26.4 g。该有机物分子式为
| A.C4H10 | B.C2H6O |
C.C3H8O | D.C2H4O2 |
将20 mL 0.1 mol·L-1的氨水与10 mL 0.1 mol·L-1的盐酸混合,所得到的溶液中离子浓度的关系错误的是( )
| A.c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| B.c(NH4+)+c(NH3·H2O)=2c(Cl-) |
| C.2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O) |
| D.c(H+)=c(NH3·H2O)+c(OH-) |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25 ℃时,该反应的平衡常数K=2.2 |
某温度下,在体积为2 L的密闭容器中充入1 mol A和b mol B气体,发生如下反应:A(g)+B(g) 2C(g),5 min后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
2C(g),5 min后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )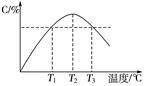
A.0~5 min,C物质的平均反应速率为0.04 mol·L-1·min-1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③n>p ④x点比y点时的反应速率慢 ⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ | C.只有①③ | D.①③⑤ |
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4 mol·L-1,c(Y2)=0.6 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的化学方程式可表示为( )
A.2X2+3Y2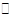 2X2Y3 2X2Y3 |
B.3X2+2Y2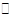 2X3Y2 2X3Y2 |
C.X2+2Y2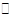 XY2 XY2 |
D.2X2+Y2 2X2Y 2X2Y |