2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式
_______________________________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与2 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
[2012·北京大兴一模]下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:___________。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:____________。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:___________。
[2012·北京卷,节选]用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。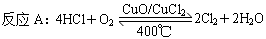
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
(1)H2O的电子式是____________。
(2)反应A的热化学方程式是___________________________________。
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为________kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)________。
下图涉及多种无机化工反应,所涉及物质都是由短周期元素组成,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化肥材料,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2:1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。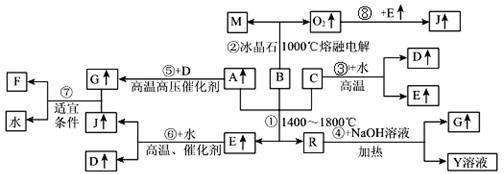
请回答下列问题:
(1)写出B化学式,F化学式:;G的空间构型。
(2)反应①的化学方程式为
(3)反应④的离子方程式为
(4)上述反应中属于非氧化还原反应的有(填写相应反应的序号)
(5)Y溶液呈性(填酸、碱或中),用离子方程式解释
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
(1)在人体血液中,HCO3-能起到稳定人体PH的作用,请用电解质溶液中的平衡解释:
(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1。c(CO32-)=0.075 mol·L-1,若t1时刻在上述体系中加入100 mL0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+ ,实线表示CO32-)。
A为芳香烃衍生物,只含C、H、O三种元素,苯环上有两个处于邻位的取代基。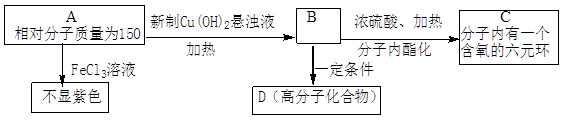
(1)B分子中含氧官能团的名称是。
(2)写出符合上述条件的A的两种可能的结构简式:;。
(3)等量的B分别与Na,NaOH,Na2CO3反应时,消耗三者物质的量之比是。
(4)符合上述条件的A,其中一种还可发生如下变化:
①A→ F的反应类型为。
②写出有关反应的化学方程式:
此A与新制Cu(OH)2悬浊液的反应:;
此A对应的B生成C的反应:。