今有①CH3COOH、②HCl、③H2SO4三种溶液,请用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度由大到小排列的是 .
(2)当它们的物质的量浓度相同时,其pH由大到小排列的是 .
(3)中和等量的烧碱溶液,需同浓度的三种酸溶液的体积大小关系为 .
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,所需烧碱溶液的体积由大到小关系为 .
在下列①Ne、②CO2、③SiO2、④CH4、⑤Na2O2、⑥MgCl2六种物质中,请用编号填空:
其中不存在化学键的是,属于原子晶体的是,是离子化合物,且离子个数之比是2:1或1:2的是,只含共价键且为直线型分子的是,既含有离子键又有共价键的是,为正四面体结构的分子是。
现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96 g D的单质跟足量盐酸反应,生成D3+和1.12 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
(1) 写出元素符号:
A,C,E。
(2) B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
(3) 用电子式表示C与E形成E2C的过程:。
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验: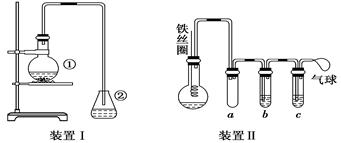
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①的化学方程式为__________________________________________.
②中离子方程式为__________________________________________________.
(2)①中长导管的作用是________________________________________________.
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用__________________________试剂洗涤.洗涤后分离粗产品应使用的仪器是____________________.
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是__________________________________________________________.
b中的试剂是__________________________________________________________.
比较两套装置,装置Ⅱ的主要优点是______________________________________
________________________________________________________________________.
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比
B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为序40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子的数目之比为2∶1。请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺为下列的________(填序号)。
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R>B单质
(2)CB3分子的空间构型是________,其固体时的晶体类型为______________。
(3)写出D原子的核外电子排布式:________________________,C的氢化物比D的氢化物在水中的溶解度大得多的原因是__________________________________________。
(4)B元素和D元素的电负性大小关系为____________。
(5)A与B形成的离子化合物的晶胞中,每个A+周围与它距离相等且最近的B-有______个,这些B-围成的空间几何构型为____________。
根据下列装置图,回答有关问题: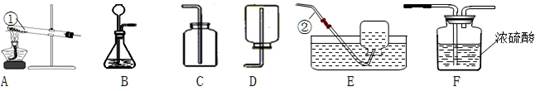
(1)写出装置图中标号仪器的名称:①;②。
(2)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:,并据此选择上图中(填字母)组装一套制取干燥二氧化碳的装置。收集二氧化碳时,验满的方法是。
(3)如选用装置A作为制取氧气的发生装置,其化学方程式为。