A、B、C、D、E五种短周期元素中,A、B、C位于同一周期相邻位置,A、C的原子序数之比为
3:4,A、B、C分别与D形成化合物分子中都含有10个电子,E的原子结构中从内到外各电子层的电子数之比为1:4:1。下列叙述中,正确的是 A.A、B、C分别与D形成的化合物的热稳定性依次减弱
A.A、B、C分别与D形成的化合物的热稳定性依次减弱
B.由A、C原子构成的分子和B、D原子构成的分子中都只含有极性共价单键
C.B、C、D三种元素可以形成酸、碱或者盐三种物质
D.E的单质在冷的浓硝酸中会发生钝化现象
下列说法正确的是
| A.pH试纸在检测溶液时不需要湿润,紫色石蕊试纸在检测气体时需要湿润并粘在玻璃棒的一端 |
| B.用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 |
| C.海带中提取碘,可将灰化后海带灰加入水中煮沸一段时间后过滤,在滤液中加入CCl4萃取后分离 |
| D.为了绘制滴定曲线,可在相同时间内测定溶液的pH |
下列说法正确的是
| A.2014年1月4日,国家首次将雾霾天气纳入自然灾情进行通报。雾霾也是一种分散系,分散剂为空气 |
| B.氯化氢溶于水的过程中虽然有H-Cl键的断裂,但没有新化学键的形成,所以该过程是物理过程 |
| C.2014年12月某市某化工市场发生爆炸,据调查为化工原料“醋酸乙烯”燃烧所致,该化工原料属于烯烃 |
| D.2014年的诺贝尔化学奖授予了超高分辨率荧光显微镜的发展者,该技术突破了光学显微镜的极限,能观察到纳米尺度的微粒,该技术还可以将研究反应速率的时间分辨率达到纳秒级水平 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1的醋酸与0.01 mol·L-1的醋酸相比,前者c(H+)大于后者的10倍 |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3-) +c(H+) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+) |
| D.在25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(NH4+)=c(SO42-) |
下列实验操作能达到目的的是
| A.除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 |
| B.除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液 |
| C.检验卤代烃中的卤原子:取足量液体与NaOH溶液共热后,再滴加AgNO3溶液 |
| D.实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗 |
下列有关实验装置(装置中略去支撑仪器)进行的相应实验,能达到实验目的的是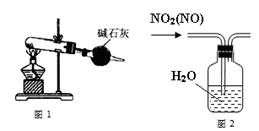

| A.用图1装置以NH4Cl为原料,装置③可用于制备NH3 |
| B.用图2所示装置可除去NO2中的NO |
| C.用图3所示装置比较KMnO4、Cl2、S的氧化性 |
| D.用图4装置制备Fe(OH)2并能较长时间观察其颜色 |