苏合香醇可以用作食用香精,其结构简式如图17所示。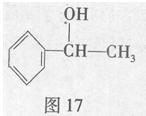
(1)苏合香醇的分子式为 ,它不能发生的有机反应类型有(填数字序号) 。
①取代反应 ②加成反应 ③消去反应
③加聚反应 ⑤氧化反应 ⑥水解反应
有机物丙是一种香料,其合成路线如图18。其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰乙;乙与苏合香醇互为同系物。 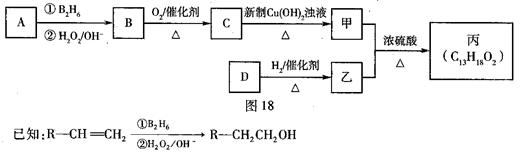
(2)按照系统命名法,A的名称是 。
(3)C与新制Cu(OH)2悬浊液反应的化学方程式为 。
(4)丙中含有两个—CH3在催化剂存在下1 mol D与2 mol H2反应可以生成乙,D可以发生银镜反应,则D的结构简式为 。
(5)甲与乙反应的化学方程式为 。
(6)苯环上有3个取代基或官能团,且显弱酸性的乙的同分异构体共有____种,其中3个取代基或官能团互不相邻的有机物结构简式为___ _。
无机化合物可根据其组成和性质进行分类:
(1)下图所示的物质分类方法名称是;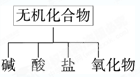
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面;(只需填一种)
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ② |
③ ④Ba(OH)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的离子方程式;
有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有(选填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是、。
(3)写出与D、E具有相同官能团的所有同分异构体的结构简式____________、______________。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是:_____________________。
(5)某学生检验C的官能团时,取1mol/LCuSO4溶液和2mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的C,加热后无红色沉淀出现。该同学实验失败的原因可能是。(选填序号)
①加入的C过多 ② 加入的C太少 ③ 加入CuSO4溶液的量过多 ④ 加入CuSO4溶液的量不够
(9分)有机物A的结构简式为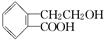 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.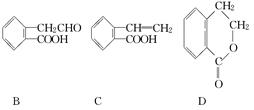
(1)B中含氧官能团的名称是________.
(2)A→C的反应类型是________;A~D中互为同分异构体的是________.
(3)由A生成B的化学方程式是______________________________________.
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H>0。
2Fe(s)+3CO2(g) △H>0。
①该反应的平衡常数表达式为K=________________;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为_____________________;
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是__________;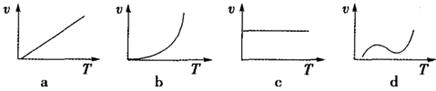
(3)三价铁盐和铝盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性.但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列化学方程式:
_____Fe(OH)3+___ClO-+____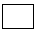 =____FeO42-+___Cl-+____
=____FeO42-+___Cl-+____ ;
;
(4)若将ag Fe和Al的混合物溶于2mol/L足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤、洗涤、干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为_____________。
工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式:
Fe2O2(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g)△H=-15.73kJ•mol-1
Fe3O4+CO(g)=3FeO(s)+CO2(g)△H=+640.4kJ•mol-1
则反应Fe2O3(s)+CO(g)=2FeO(s)+CO2(g)的△H=__________;
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使H+难放电、阳极电极不溶解).写出电解总反应离子方程式____________________;
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的___极发生___反应。(填“氧化”或“还原”)
(4)实验室用镀锌钢板与稀硫酸制取标准状况下的氢气4.48L,则该反应转移的电子数为______,消耗硫酸的物质的量是_____________。